1,3-Diolefinas
(Ir a página principal http://organica1.org/ )
2.1.1. Síntesis
históricas del 1,3-butadieno
2.1.2. 1,3-butadieno
de las fracciones C4 de craqueo
2.1.3. 1,3-butadieno a partir de alcanos y alquenos
C4
2.1.4. Aplicaciones
del 1,3-butadieno
2.2.1 Isopreno
obtenido de las fracciones de craqueo C5
2.2.2. Isopreno por
reacciones de síntesis
Las diolefinas o dienos de
importancia industrial tienen los dobles enlaces C=C conjugados, es decir, en
posición 1,3 entre sí. Se distinguen, pues, de otras combinaciones con dobles
enlaces aislados por sus diferentes propiedades de reacción; sobre todo, por su
más alta reactividad. Esta es la razón también de que los 1,3-dienos no se
encuentren libres en la naturaleza.
A las 1,3-diolefinas más
importantes industrialmente, pertenecen los C4 y C5
dienos, el butadieno, el cloropreno, el isopreno y el ciclopentadieno.
2.1. 1,3 Butadieno
El butadieno (denominado sistemáticamente
1,3-butadieno) posee la mayor importancia industrial entre los antes
mencionados C4 y C5 dienos. En ambas guerras mundiales se
produjo una amplia investigación y rápido desarrollo, especialmente en
Alemania, para su subsiguiente transformación en elastómeros.
Además, la disponibilidad de butadieno se ha
mejorado en los últimos años tanto, que también se ha transformado en material
de partida importante para síntesis químicas. La producción mundial de
butadieno (con exclusión de los países del Comecon) alcanzó en 1977 unos 3,9
millones de toneladas, frente a unos 3,8 en 1976.
2.1.1.
Síntesis históricas del 1,3-butadieno
Los primeros procesos industriales de obtención
de butadieno estuvieron basados en los productos derivados del carbón, tales
como acetileno, acetaldehído, etanol y formaldehído. En esencia hay tres
caminos para obtenerlo, que se caracterizan por la formación de la cadena C4
del butadieno, bien sea por dos unidades C2 o por unidades C2
y C1 ordinariamente en proceso de pasos múltiples.
Así todavía en algunos lugares una parte del
butadieno se obtiene a partir de
acetileno por un proceso de cuatro etapas. Para ello, el acetileno se
transforma primero en acetaldehído y después, por aldolización, a acetaldol,
que se reduce a 110ºC y 300 bars, con un catalizador de Ni a 1,3-butandiol. En
la cuarta etapa se deshidrata, finalmente, el 1,2-butandiol a 270ºC con
catalizador de polifosfato sódico en fase gaseosa:
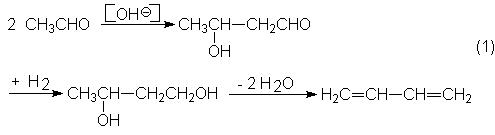
La selectividad para el
butadieno alcanza como un 70 % (CH3CHO).
Otro proceso de obtención de
butadieno, conocido como proceso Lebedew, emplea etanol como materia prima. Se
desarrolló en la URSS y sigue
empleándose allí, así como
también en la India y Brasil, a base de etanol de fermentación. Para ello se
deshidrodimeriza el etanol a 400ºC con un catalizador MgO-SiO2, en
una etapa, con separación de agua:
![]()
La selectividad para el
butadieno alcanza como un 40%. Este proceso puede seguir siendo interesante
para aquellos países que no tengan industria petroquímica y que además
dispongan de etanol barato obtenido por fermentación alcohólica.
El tercero de los procesos
históricos, el proceso Reppe, se realizó primeramente con etileno y
formaldehído, que dan 2-butin-1,4-diol y después 1,4-butandiol, producto que
también en la actualidad tiene una gran importancia industrial (ver apartado
4.3). Después sigue una doble eliminación de agua directamente, pero que por
ventajas técnicas, generalmente se
realiza en dos etapas con tetrahidrofurano como intermedio. El proceso Reppe
es, en la actualidad, completamente antieconómico.
Los modernos procesos de
obtención industrial de butadieno, por ahora, son exclusivamente de base
petroquímica. Son sustancias de partida baratas las fracciones C4 de
craqueo o mezclas de butano-buteno procedentes del gas natural o de gases de
refinería.
2.1.2.
1,3-butadieno de las fracciones C4 de craqueo
Las fracciones C4
con un contenido en butadieno aislable económicamente, están a disposición de
los países en que se obtiene etileno craqueando con vapor la nafta o fracciones
altas del petróleo. La parte de fracción C4 procedente de los
actuales craqueos de alta intensidad de nafta puede ser de un 9% en peso del
producto disociado con un 45-50% en peso de butadieno.
Entre los países con esta
base de materia prima para la obtención de butadieno se encuentran
principalmente Europa Occidental y
Japón. En los EE.UU. se prefiere hasta ahora la disociación del gas natural y gases de refinería que, en
comparación con la de nafta o gasoil, sólo da una pequeña parte de butadieno.
La tabla siguiente indica el contenido en butadieno obtenido en plantas de
etileno por craqueo de diferentes productos de partida, a la correspondiente
intensidad de craqueo:
|
Producto empleado |
Contenido de butadieno |
|
Etano |
1- 2 |
|
Propano |
4- 7 |
|
n-butano |
7-11 |
|
Nafta |
12-15 |
|
Gasoil |
18-24 |
Tabla 1. Contenido en butadieno (en
kg) por 100 kg de los diferentes productos empleados.
De todas formas también en
los EE.UU. aumenta en importancia la disociación de nafta y Gasoil. Ya en 1976,
un 36% de la capacidad de butadieno procedía de su aislamiento de dichos
productos de disociación y en 1977 el 55%. Esta participación debe aumentar
claramente en los años venideros, puesto que todos los procesos de disociación
proyectados para su obtención son únicamente a base de disociación de
nafta/gasoil. Posiblemente, a principios de los años noventa habrá perdido gran
parte de su importancia en los EE.UU. la deshidrogenación de butano/buteno.
El aislamiento del butadieno
de una mezcla de la fracción C4 de hidrocarburos no es posible por
simple destilación, puesto que todos los componentes hierven en un intervalo de
temperaturas muy estrecho y algunos, además, forman mezclas azeotrópicas. Por
esta razón se han desarrollado dos procesos, basado uno en la separación
química y el otro en la separación física:
·
El proceso de separación
química más antiguo aprovecha la formación de complejo de butadieno con el
acetato curpoamónico [Cu(NH3)2]OAc. Fue desarrollado por la Esso como método de
extracción para el tratamiento de fracciones C4 con pequeño
contenido de butadieno. Dichas fracciones han de contener pocas impurezas de
acetilenos, puesto que si no el proceso resulta perturbado por la formación de
espuma. Otra dificultad es la regeneración relativamente costosa de la
disolución de extracción.
·
Todos los procesos modernos
para el aislamiento del butadieno se basan en el principio físico de la
destilación extractiva. Por adición de disolventes orgánicos componentes de una
mezcla (en este caso el butadieno). Estos quedan en el fondo de la columna de
destilación con el disolvente, mientras que las partes volátiles, antes no
separables, que les acompañan, se separan en la cabeza de la columna. Como
disolvente para la destilación extractiva se utilizan principalmente acetona,
furfural, acetonitrilo, dimetilacetamida, dimetilformamida y
N-metilpirrolidona.
Las destilaciones extractivas
son especialmente adecuadas para las fracciones de craqueo C4 que
actualmente se obtienen ricas en butadieno con un contenido elevado de
alquinos, entre otros, metil-, etil- y vinilacetileno, así como metilaleno, es
decir, 1,2-butadieno. En los modernos procesos con disolventes, por ejemplo,
dimetilformamida (Nippon Zeon, VEB Leuna) o la N-metilpirrolidona (BASF), la
separación de alquinos es un paso parcial en el proceso total. En los más
antiguos, principalmente desarrollados y empleados en los EE.UU., en que se
utilizan como disolventes acetona, furfural (Phillips Petroleum) o acetonitrilo
(Shell, UOP, Atlantic Richfield), había una separación previa de alquinos de la
fracción C4, por ejemplo, por hidrogenación parcial, necesaria para
evitar la formación de resinas que interfiere.
Simplificadamente, el
principio de la extracción con disolvente de butadieno de una fracción de
craqueo C4 se puede explicar así: Se lleva al extremo inferior de
una columna de extracción la fracción C4 completamente vaporizada.
El disolvente (por ejemplo, dimetilformamida o N-metilpirrolidona) fluye desde
arriba en contra de la mezcla gaseosa y va extrayendo en su caída el butadieno
más soluble y pequeñas porciones de butenos. Se lleva al extremo inferior de la
columna de extracción una parte del butadieno puro obtenido con el fin de
eliminar progresivamente los butenos. Los butenos se eliminan en la cabeza de
la columna de separación. En otra columna, denominada de desgasificación, se
separa el butadieno por ebullición de los disolventes y, finalmente, se le
redestila. En el proceso de la BASF con N-metilpirrolidona se obtiene butadieno
con una pureza del 99,8%. El rendimiento en butadieno supone el 96% referido al
contenido inicial de butadieno de la fracción de craqueo C4.
El proceso de la BASF de
extracción de butadieno con N-metilpirrolidona (NMP) se utilizó por primera vez
en la EC-Dormagen, en una instalación
industrial, en 1968.
En 1974, la capacidad de
producción anual de las instalaciones de la EC era de 180 000 toneladas. En ese
mismo año la capacidad de las instalaciones en producción o en construcción que
aplicaban el proceso de la BASF, era de 1 000 000 de toneladas al año, en
conjunto.
2.1.3. 1,3-butadieno a partir de alcanos y alquenos
C4
Los productos empleados para
deshidrogenación pura o deshidrogenación
en presencia de oxígeno, son las mezclas de butano y buteno procedentes de gas
natural y gas de refinerías, de que
sobre todo disponen especialmente los EE.UU. Por ello, los procesos
industriales se han desarrollado casi exclusivamente en aquel país, en donde
siguen actualmente aplicándose con preferencia. Igual ocurre en algunos países de América del Sur. En
Europa occidental, en 1972, se obtuvo solamente el 3% de butadieno por
deshidrogenación y en 1978 dejó de realizarse esta deshidrogenación no sólo en
Europa, sino también en Canadá y África del Sur. En el Japón, desde 1967, está
parada la última instalación de deshidrogenación Houdry después de ocho años de
trabajo.
La deshidrogenación de
n-butano y n-butenos son procesos endotérmicos, que están ligados a un consumo
enorme de energía:
![]()

Para conseguir
transformaciones económicas, se tiene que emplear temperaturas relativamente
altas de 600-700ºC. El n-butano necesitapara alcanzar la misma velocidad de
reacción una temperatura 130ºC más alta que para los n-butenos. En estas
condiciones se producen reacciones
secundarias de escisión y derivadas de las combinaciones no saturadas en
magnitud notable. Por lo cual, se elige un tiempo de permanencia corto y se
emplean catalizadores que actúan selectivamente.
El aumento de volumen que se
produce en el transcurso de la deshidrogenación, como en el caso del craqueo en
vapor, se favorece por adición de vapor de agua. La disminución de la presión
parcial de los hidrocarburos que se alcanza de estemodo, disminuye la
separación de cock, la isomerización y la polimerización.
Si los catalziadores son
sensibles al vapor de agua., el proceso de deshidrogenación se realiza
predominantemente con presión disminuida. Con lo que al mismo tiempo se
desplaza el equilibrio de deshidrogenación favoreciendo la formación de
butadieno.
A los procesos industriales
más importantes pertenece, como uno de los más antiguos de los empleados para deshidrogenación del butano (proceso
Catadieno), el proceso en una etapa de la Houdry. Se realiza por empleo de un
catalizador sensible al agua de óxido Cr-Al a 600ºC y 15 milibars, pero que a
los pocos minutos se tiene que regenerar por inversión de aire (combustión de
los depósitos de coke). Entre el período deshidrogenante y el de regeneración
hay que realizar una evacuación del catalizador para separar la mezcla de
reacción. Para realizar el proceso funcionan tres reactores acoplados en una
unidad en que se alternan las tres etapas formando un proceso cíclico. El
elevado aporte de energía necesaria para la deshidrogenación se consigue por
combustión de los depósitos de coke sobre el catalizador (método adiabático).
Otro método ampliamente
extendido de deshidrogenación de buteno con adición de vapor de agua, es el
proceso Dow. Se realiza a 600-675ºC y 1 bar aproximadamente, con un catalizador
de fosfato de Ca-Ni, que se estabiliza con Cr2O3.
Análogamente a la deshidrogenación del etilbenceno a estireno el calor procede
de vapor de agua recalentado (H2O: buteno = 20: 1). La transformación de buteno resulta de un 50% y la
selectividad en butadieno es de un 90%. El catalizador tiene que regenerarse
durante 11 minutos después de cada 15 minutos de reacción aproximadamente.
Prácticamente se trabaja con reactores en paralelo, que funcionan alternativamente,
regenerándose y deshidrogenado. El butadieno se aisla de la mezcla de reacción
por destilación extractiva.
Procesos semejantes se han
utilizado por la Shell con un catalizador de óxidos de Fe-Cr con adición de K2O
y por la Phillips Petroleum con un catalizador de bauxita, óxido de Fe.
Junto a los procesos de pura
deshidrogenación de hidrocarburos C4 a butadieno han ganado
importancia en tiempos recientes otros métodos de deshidrogenación en presencia
de oxígeno. En estos procesos, los llamados de oxideshidrogenación, el
equilibrio de deshidrogenación entre butenos y butadieno se desplaza por
adición de oxígeno en el sentido de una mayor formación de butadieno.
Ello se debe a la forma de
actuación del oxígeno que no se limita a la subsiguiente combustión del H2,
sino que inicia la deshidrogenación por la abstracción de hidrógeno de la
posición alílica. A temperaturas tan altas (hasta 600ºC), el O2
actúa también como regenerador oxidativo del catalizador.
Industrialmente se añade
suficiente oxígeno, en forma de aire, para que la reacción exotérmica de
formación de agua proporcione el calor necesario para que se produzca el
proceso endotérmico de la deshidrogenación. De este modo se mejora la
transformación del buteno, la selectividad de formación de butadieno y la
duración del catalizador. Con exceso de aire se controla la temperatura máxima
por adición de vapor de agua. Como catalizadores se usan generalmente mezclas
de óxidos de Bi-Mo o de Sn-Sb.
Como ejemplo de un proceso de
deshidrogenación empleado industrialmente se indica el introducido por
Phillips. Proceso O-X-D (oxydehidrogenación) para la obtención de butadieno a
partir de n-butenos. Sobre un catalizador en lecho estático de composición
desconocida se introducen n-butenos, vapor de agua y aire que reaccionan a
480-600ºC.
Para transformaciones de
buteno del 75 hasta el 80% se alcanza una selectividad en butadieno del 88-92%.
Este proceso se realiza en Texas en una instalación con capacidad anual de 140
000 toneladas.
También la Petro-Tex obtiene
en los EE.UU., desde 1965, butadieno por oxideshidrogenación de butenos
(proceso Oxo-D) con aire u oxígeno, en presencia de un catalizador heterogéneo.
A temperatura de reacción de 550-600ºC y con adición de vapor de agua para
controlar la selectividad, se consigue, para una conversión del 65%, alcanzar
una selectividad en butadieno de hasta el 93% (n-butenos).
Otro principio para la
separación de hidrógeno del equilibrio de deshidrogenación en su reacción con
halógenos para formar halogenuros de hidrógeno, de los cuales finalmente se
recupera el halógeno por oxidación. Como aceptor de hidrógeno, en la
deshidrogenación de butano para obtener
butadieno, la Shell usó algún tiempo iodo en el proceso <<Idas>> (Francia).
2.1.4.
Aplicaciones del 1,3-butadieno
La aplicación industrial del
butadieno se basa en su aptitud para la homopolimerización y en su fácil
copolimerización con numerosos monómeros no saturados.
Puesto que posee varios
centros de reactividad, el butadieno participa en numerosas reacciones, sobre
todo, en las de adición y ciclación que llevan a síntesis de importantes
productos intermedios.
A los productos mencionados
en primer lugar corresponde una serie de elastómeros, que según como
polimericen pueden ser elásticos, estables a la abrasión, al desgaste, al frío
y al calor, así como estables a la oxidación, al envejecimiento y a los
disolventes. Como monómero de copolimerización con butadieno se emplean
preferentemente estiranos y acrilonitrilo. Para la clasificación de los
elastómeros se usa un código con la denominación <<rubber>>. Las tres clases más importantes de hule son: SBR =
estireno-butadieno-hule (rubber) (antigua denominación Buna -S de la IG), BR
=hule de butadieno
Producto |
EE.UU. 1976 |
Europa
occ. 1976 |
1978 |
Mundo 1978 |
|
Hule estireno-butadieno (SBR) |
57 |
58 |
54 |
58 |
|
Hule polibutadieno (BR) |
16 |
13 |
14 |
15 |
|
Hule cloropreno (CR) |
8 |
6 |
6 |
6 |
|
Hule de olefinas (EPM, EPDM) |
6 |
6 |
6 |
5 |
|
Butilhule (IIR) |
5 |
7 |
7 |
6 |
|
Hule poliisopreno (IR) |
3 |
5 |
6 |
4 |
|
Nitri-hule (NBR) |
3 |
4 |
5 |
5 |
|
Otros |
2 |
2 |
2 |
1 |
|
Producción total/consumo total (en millones toneladas) |
2,24 |
1,51 |
1,58 |
5,51 |
Tabla 2. Hule de síntesis (en %).
(1,4-cis-polibutadieno) y
NBR= nitril-hule (copolímero de butadieno-acrilonitrilo). La importancia
relativa de cada una de las clases de hule se deduce claramente de las
producciones de hule de síntesis en los EE.UU. en 1976 y del consumo de hule de
síntesis en Europa occidental en 1976.
A otro grupo pertenecen los
terpolímeros para su elaboración
termoplástica, como ABS-polimerizado, que se obtiene por copolimerización de
acrilonitrilo, butadieno y estireno, y que se distinguen por su alta tenacidad
a los golpes, incluso a bajas temperaturas.
La siguiente prospección de
las aplicaciones del butadieno en los EE.UU. (1974) muestra que el 73% de la
producción total de butadieno se utiliza en la fabricación de homo- y
copolímeros.
|
Producto |
Participación % |
|
Hule
estireno-butadieno (SBR) |
47 |
|
Polibutadieno
(BR) |
17 |
|
Adiponitrilo |
8 |
|
Cloropreno |
8 |
|
Polímeros-ABS |
6 |
|
Hule-nitrilo
(NBR) |
3 |
|
Diversos |
11 |
Tabla 3. Aplicaciones
del butadieno en los EE.UU. (1974).
El butadieno actualmente gana
creciente importancia como producto intermedio. Así se obtiene de él el
cloropreno, a través del producto de adición con cloro, el
3,4-dicloro-1-buteno, que por eliminación de HCI da lugar al mismo (ver
apartado 5.3), y por hidrocianuración, es decir, adición duplicada de CNH, se
obtiene el adiponitrilo (ver apartado 10.2.1.1). También se puede transformar
en 1,4-butandiol mediante diferentes etapas intermediarias (ver apartado 5.3).
La ciclomerización del
butadieno en presencia de catalizadores organometálicos produce
1,5-ciclooctadieno y por trimerización el 1,5,9-ciclododecatrieno. Ambos
compuestos son productos de partida
importantes para la preparación de poliamidas superiores (ver apartado
10.1.2 y 10.3.2).
Finalmente , el butadieno
reacciona reversiblemente en adición 1,4 con SO2 para dar sulfoleno,
que por hidrogenación pasa a sulfolán, o dióxido de tetrahidrotiofeno,
térmicamente muy estable:
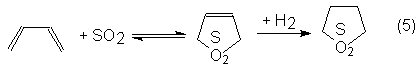
El sulfolán es un disolvente
industrial, aprótico y muy estable, que, por ejemplo, se emplea para la
destilaciónextractiva de aromáticos o junto con diisopropanolamina en el
proceso sulfinol para purificación de gases El productor de sulfolán es la
Shell, con una capacidad de 11 000 toneladas anuales.
2.2.
Isopreno
El interés industrial por el
isopreno (2-metil-1,3-butadieno) y por sus procesos de obtención crece desde
que se ha conseguido dominar la
polimerización estereo selectiva del isopreno. El 1,4-cis-poliisopreno isotáctico
que así se obtiene es completamente idéntico al hule natural y le sobrepasa
incluso en pureza y uniformidad.
En 1975 la producción mundial
de isopreno fue de 700 000 toneladas.
La obtención del isopreno
tiene lugar, en gran parte, por procesos análogos a los utilizados para el
butadieno, es decir, por aislamiento directo de las fracciones de craqueo C5
o por deshidrogenación de los i-alcalinos e i-alquenos de C5.
Al contrario que en el butadieno, para el isopreno hay reacciones de formación
del esqueleto C5 por unión de unidades carbonadas más pequeñas que
desempeñan un papel importante en la
producción total. De todas formas por el incremento mundial de instalaciones de
craqueo con vapor a base de nafta y de gasoil, especialmente en los EE.UU., la
proporción de isopreno obtenido por síntesis retrocederá sensiblemente frente
al obtenido por extracción.
2.2.1 Isopreno obtenido de las fracciones de craqueo
C5
Las materias primas para
obtener isopreno son las fracciones C5 de la disociación de nafta, a
partir de las cuales se puede aislar por extracción o actualmente también por
destilación.
El método de aislamiento
directo de isopreno de las correspondientes fracciones de los productos de
disociación de nafta tiene la ventaja de que sin el empleo de etapas adicionales
de síntesis se le puede obtener. Este método es interesante económicamente, aun
cuando la concentración de isopreno en una fracción C5 típica sea
solamente de un 10-15% en peso. Los otros componentes de la fracción C5
son pentanos, ciclopentadieno/diciclopentadieno, piperileno y pentenos.
Diferentes procesos de
extracción de butadieno se pueden adaptar modificados para la extracción de
isopreno, como, por ejemplo, el proceso de la BASF con N-metilpirrolidona, o el
del acetonitrilo de la Shell y de la Goodrich-Atlantic Richfield. Así, por
ejemplo, en el Japón se han empleado en instalaciones industriales las
extracciones según el proceso Nippon-Geon NMP y el ISR con acetonitrilo,
alcanzando una capacidad de 30-40 000 toneladas al año.
Recientemente la Goodyear
obtiene isopreno por destilación fraccionada de fracciones C5 de
craqueo al vapor. Este procedimiento exige pequeño gasto de energía y se emplea
en Francia desde 1976 en una planta con capacidad anual de 40 000 toneladas.
En los EE.UU. se emplean preferentemente
los procesos de deshidrogenación de i-pentano e i-pentenos. Los productos de
partida son las fracciones C5 de los procesos de craqueo
catalíticos, que como mezcla se someten
a deshidrogenación. De esta forma y por su mayor reactividad, se deshidrogenan
preferentemente los alquenos antes que los alcanos. La subsiguiente
purificación, especialmente la separación de 1-metil-1,3-butadieno (piperileno)
es muy costosa. Por ello, la Shell hace una separación previa del
metil-2-buteno de los restantes productos C5 por la llamada
extracción Sinclair, que se produce con SO4H2 del 65%. El
ácido isomeriza inicialmente la mezcla de 2-metilbutenos principalmente a
2-metil-2-buteno y luego forma el éster sulfúrico ácido:
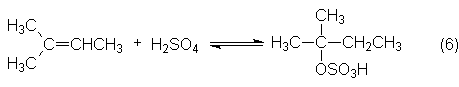
Finalmente, el éster se
vuelve a descomponer a 35ºC y se extrae la olefina C5. La necesaria
deshidrogenación a isopreno se asemeja por completo al proceso similar del
butadieno (ver apartado 5.1.3). La Shell emplea un catalizador F2O3-Cr2O3-K2CO3
a 600ºC. El isopreno puro (99,0-99,5% en peso) se obtiene por destilación
extractiva con acetonitrilo. Según este proceso existen instalaciones de la
Shell para isopreno en Holanda, con una capacidad anual de 70 000 toneladas, y
en EE.UU. La Goodyear con una capacidad de 40 000 toneladas al año. En la URSS
hay tres fábricas que obtienen en conjunto 180 000 toneladas al año de
isopreno, igualmente por deshidrogenación de i-pentenos, según un proceso no
del todo conocido.
2.2.2.
Isopreno por reacciones de síntesis
Esencialmente existen cuatro
métodos de síntesis para la obtención del esqueleto C5 a aprtir de
unidades carbonadas más pequeñas, de los cuales dos aún se realizan en
instalaciones industriales:
·
Adición de acetona al
acetileno para dar 2-metil-3-butin-2-ol con subsiguiente hidrogenación parcial
y deshidratación.
·
Dimerización de propeno a
i-hexeno con subsiguiente
desmetanación.
·
Doble adición de formaldehído
al i-buteno que da 4,4-dimetil-1,3-dioxano seguida de deshidratación y
separación de formaldehído.
·
Disminución de i-buteno y 2-buteno
para dar 2-metil-2-buteno y
deshidrogenación final.
El proceso acetona-acetileno
fue desarrollado por Snam-Progetti y se
utiliza todavía en una instalación en Italia con una capacidad anual de 30 000
toneladas de isopreno. En primera fase se hacen reaccionar la acetona y el
acetileno a 10-40ºC y 20 bars en amoniaco líquido como disolvente y en
presencia de KOH como catalizador para dar metilbutinol, que tras hidrogenación
selectiva a metilbutenol y deshidratación de éste a 250-300ºC a presión normal
y sobre AI2O3 se transforma en isopreno:
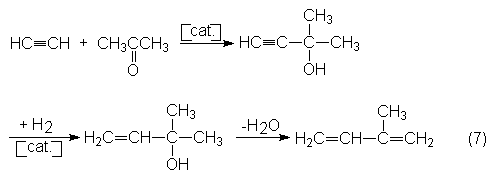
La selectividad total en
isopreno alcanza un 85% (CH3COCH3, C2H2).
Por el segundo método, el
camino i-hexeno, se realiza el proceso
de la Gooyear-Scientific Design. La dimerización del propeno con un catalizador
de Ziegler (por ejemplo, tri-n-propilaluminio), produce 2-metil-1-penteno (ver
apartado 3.3.1), que luego se isomeriza por un catalizador ácido sobre soporte
a 2-metil-2-penteno, el cual, por vapor
recalentado y cantidades catalíticas de Hbr a temperatura de 650-800ºC se encinde en isopropeno y
metano:
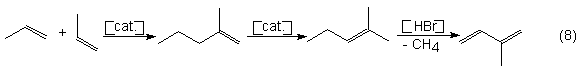
La selectividad en isopropeno
alcanza un 50% (propeno).
La Goodyear tuvo varios años
una instalación en Texas, pero hace algún tiempo y por motivos económicos dejó
de funcionar.
La tercera vía que emplea
como producto intermedio el m-dioxano se ha investigado múltiples veces y
también se ha desarrollado industrialmente por diversas empresas (Bayer, IFP,
Marathon Oil, Kuraray y en la URSS).
El primer paso es una <<reacción de Prins>> entre formaldehído e i-buteno. La reacción se realiza
en presencia de un ácido mineral fuerte como sulfúrico o un cambiador de iones
ácido a temperatura de 70-95ºC y unos 20 bars aproximadamente. El formaldehído
en disolución acuosa reacciona con una fracción C4, libre de butadieno,
que cotiene el i-buteno y se forma el 4,4-dimetil-1,3-dioxano:
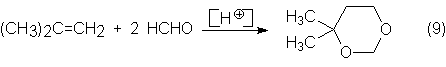
En el próximo paso se disocia
el derivado de dioxano a 240-400ºC sobre H3PO4/carbón o
Ca3(PO4)2 como catalizador en presencia de
agua adicional:
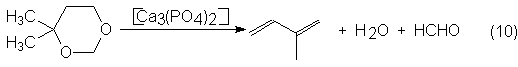
La selectividad total del isopreno
alcanza un 77% (i-buteno).
Como productos secundarios se
obtienen en ambas etapas polioles, de cuya cantidad depende grandemente su
economicidad. Según este proceso funciona una instalación de la Kuraray en
Japón, con una capacidad anual de 30 000 toneladas. La Kuraray emplea además el
4,4-dimetil-1,3-dioxano para obtener también 3-metil-3-metoxibutanol por
hidrogenólisis selectiva, que es un disolvente barato.
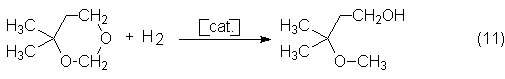
También en la URSS y en
Europa oriental hay algunas instalaciones en servicio. Recientemente diferentes
empresas han hecho propuestas para una simplificación del proceso y mejora de
la rentabilidad de la vía de m-dioxano. Así, según la Takeda Chemical es
posible la obtención de isopreno en una etapa a partir de i-buteno y
formaldehído en fase gaseosa a 300ºC y 1 bar, por ejemplo, catalizada por
óxidos de silicio, antimonio o tierras raras. La Sun Oil propone para la
transformación en un solo paso, en lugar de formaldehído, emplear metilal (CH3O)2CH2
por que es más estable que el formaldehído, y sólo se descompone una pequeña
parte en CO y H2. El dioxolano es otra fuente de formaldehído
sugerida por la Sumitomo Chemical para la misma reacción.
Otra nueva simplificación y
mejora debe dar también la transformación en un paso del i-buteno con metanol y
O2 según la Sumitomo Chemical, que transcurre con la formación de un
formaldehído formado en el proceso:

Como catalizador se emplean H3PO4-MoO3/SiO2
sistemas de óxidos mixtos a base de
Mo-Bi-P-Si, Mo-Sb-P-Si o H3PO4-V-Si. A 250ºC la
transformación de i-buteno alcanza un 12% con una selectividad en isopropeno
del 60% (i-buteno) y 40% (CH3OH). Simultáneamente el metanol se
oxida en una gran parte a formaldehído.
Las ventajas potenciales de
este proceso, como componente C1 barato y los pequeños costosos de
inversión de un proceso en un paso, tienen primero que comprobarse en
instalaciones industriales.
La cuarta vía de obtención de
un precursor del isopreno no se ha empleado hasta ahora industrialmente, no
obstante el interés desesperado. Es análoga a la dismutación del propeno a
2-buteno y etileno desarrollada por la Phillips Petroleum y perfeccionada por
otras empresas (ver apartado 3.4). Se
trata en este caso de la dismutación de i-buteno y 2-buteno, que se obtienen
del refinado del butadieno (ver apartado 5.1.2):
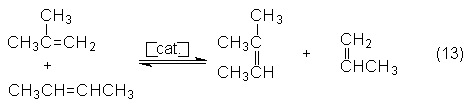
El 2-metil-2-buteno obtenido
puede finalmente ser deshidrogenado a isopreno.
El isopreno se usó mucho
tiempo sólo como comonómero con i-buteno para la fabricación del hule butilo.
Como sólo se utilizaba una porción pequeña, de 2-5% en peso de isopreno, en el
copolímero, su consumo era pequeño. El isopreno adquirió su primera gran
importancia con la fabricación del hule de 1,4-cis-poliisopreno, que a causa de
su elevada estabilidad térmica y duración
se emplea para la fabricación de cubiertas, especialmente las radiales.
La prospección estimada de producción mundial de isopropeno en 1975 da al
poliisopreno el 94% y al hule butilo el 3%; a los demás copolímeros, tales como
acrilonitrilo y otras aplicaciones, igualmente el 3%.
En Europa occidental, son
fabricantes de poliisopreno la Shell en Holanda, Anic en Italia y
Goodyear/Michelin en Francia. En 1976 la producción occidental ascendió a unas
230 000 toneladas y en los países del bloque oriental a unas 650 000 toneladas.
2.3.
Cloropreno
El cloropreno
(2-cloro-1,3-butitadieno),se sitúa por su importancia técnica detrás del
butadieno y el isopreno.
Productores son, entre otros, la DuPont y Petrotex en los
EE.UU., con capacidades de 185 000 toneladas al año (1973) y Bayer en Dormagen,
con una capacidad anual de 50 000 toneladas aproximadamente. La producción de
la Hoechst AG en la fábrica de Knapsack se paró a mediados de 1974. Los
productos de partida para la obtención de cloropreno son el acetileno en los
procesos primitivos y el butadieno en los modernos.
La síntesis histórica del
cloropreno transcurre en dos etapas. Se inicia con la dimerización del
acetileno a vinilacetileno en una disolución acuosa clorhídrica de CuCI y NH4CI
a 80ºC en una torre de reacción:
![]()
El considerable desprendimiento
de calor se elimina por vaporización de agua. La transformación de C2H2
alcanza aproximadamente el 18% y la selectividad en vinilacetileno hasta el
90%, siendoel principal producto secundario que se obtiene el divinilacetileno.
En la segunda etapa se adiciona HCI a 60ºC al vinilacetileno y se obtiene el
cloropreno:
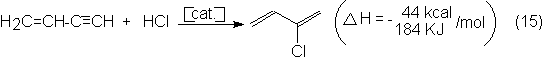
Como catalizador sirve
igualmente una disolución clorhídrica de CuCl. La selectividad en cloropreno
alcanza aproximadamente el 92% (vinilacetileno). Los principales productos
secundarios son metilvinilcetona y 1,3-dicloro-2-buteno.
Los nuevos procesos de
cloropreno se basan en butadieno como materia de partida barata. Si bien la transformación en
cloropreno aparece relativamente fácil y sencilla y se había descrito hace
tiempo, se necesitaron intensos trabajos de la British Distillers y
posteriormente de la BP antes de lograr un proceso económico, que es el que
sigue la Distugil (50% BP) en una
instalación con capacidad de producción anual de 30 000 toneladas de
cloropreno.
Luego aparecieron numerosos
otros procedimientos a base de butadieno, hasta el punto que su participación
en la producción de cloropreno en 1972 llegó ya casi al 25%.
Para la obtención de
clororpreno de butadieno, se le hace reaccionar primeramente con CI2
según un mecanismo de cadena de radicales en fase gaseosa a 300ºC y presión
normal, dando una mezcla de 3,4-dicloro-1-buteno, así como cis- y
trans-1,4-dicloro-2-buteno:
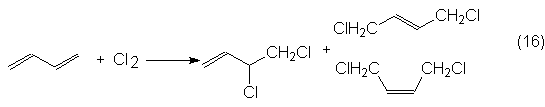
El aducto 1,4 que no es
apropiado para obtener cloropreno, se puede isomerizar al aducto 1,2 por
calentamiento con cantidades catalíticas de CuCI o también con sales de hierro.
El equlibrio de reacción se desplaza continuamente en el sentido conveniente
por destilación del isómero 3,4 (p.eb. 123ºC frente a 155ºC).
El proceso de oxicloración del
butadieno ha sido, en efecto, desarrollado por diferentes empresas (ICI,
Monsanto, Shell); pero hasta ahora no ha habido ninguna aplicación industrial.
Por dehidrocloración con
lejías alcalinas diluidas a 85ºC se obtiene el cloropreno:
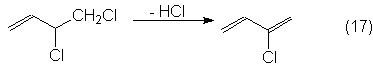
Todas las producciones de
nuevas instalaciones de obtención de cloropreno se basan en este proceso en
tres etapas, puesto que la transformación directa del butadieno a cloropreno,
por su poca selectividad, no ha conducido hasta ahora a ningún proceso
económico.
La autooxidación del
cloropreno produce un peróxido que puede iniciar la polimerización. Por ello,
se deben tomar precauciones para evitar la presencia de incluso trazas de
oxígeno en los procesos de deshidrocloración y purificación.
Además, se introducen compuestos
de azufre que son unos inhibidores muy eficases de la polimerización.
El cloropreno se emplea casi
exclusivamente para obtener hule de cloropreno, los llamados Neoprenoâ o Bayprenoâ. Se distinguen
principalmente de otros tipos de hule por su gran estabilidad frente a la luz
solar y a los aceites.
El 1,4-dicloro-2-buteno que
se forma como producto intermedio en la obtención del cloropreno, se emplea en
cantidades limitadas como producto de partida para otras transfroamciones como
a adiponitrilo (ver apartado) 10.2.1.1),
1,4-butandiol y tetrahidrofurano. Según el proceso desarrollado por Toyo
Soda para obtener 1,4-butandiol, se
hidroliza el 1,4-diclorobuteno en presencia de un exceso de formiato sódico a
unos 110ºC:
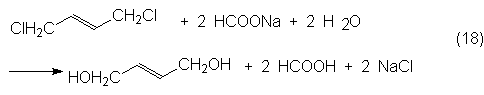
Tras la hidrólisis se
neutraliza el fórmico libre con NaOH.
La transformación se produce
casi al 100% con una selectividad en 1,4-butandiol superior al 90%.
Una hidrólisis directa
llevaría una clara menor selectividad a causa de la formación de productos de
policondensación y formación de 3-buten-1,2-diol.
Finalmente, la disolución
acuosa del 1,4-butendiol se hidrogena a 1,4-butanodiol en presencia de un
catalizador de Ni/AI a unos 100ºC y 270 bars aproximadamente.
Toyo Soda explota por este
procedimiento dos instalaciones con una capacidad conjunta anual de unas 7000
toneladas de 1,4-butandiol y 3000 de tetrahidrofurano, por deshidratación del
1,4-butandiol.
2.4.
Ciclopentadieno
El ciclopentadieno es otra
1,3-diolefina de importancia industrial, que se encuentra en pequeñas
cantidades en el alquitrán de hulla, así como en más altas concentraciones,
entre 15 y 25% en peso, en las fracciones C5 de las mezclas de
craqueo de nafta. Su participación, referida a la producción de etileno, es de
un 2-4% en peso. Con las nuevas construcciones de grandes instalaciones de
craqueo con vapor para la obtención de etileno, el ciclopentadieno también
resulta un material de partida barato. Pero, debido a su falta de demanda,
suele quedar en la fracción C5 que, después de extraer las
diolefinas y de someterse a hidrogenación, se añade a los carburantes como
componente de alto índice de octano.
El único productor de ciclopentadieno de procedencia petroquímica es hasta ahora, en Europa, la Shell de Holanda, con una capacidad aproximada de 25 000 toneladas al año.
El ciclopentadieno se
obtiene, en la actualidad, preferentemente en el transcurso de la pirólisis de
bencina, en que se aprovecha su tendencia a la dimerización (como caso especial
de reacción de Diels-Alder). Para ello se calienta la fracción C5 a
140-150ºC y a presión, o se deja varias horas a 100ºC. En estas condiciones el
ciclopentadieno se dimeriza a diciclopentadieno (preferentemente en su forma
endo), el cual hierve aproximadamente a 130ºC por encima de la temperatura de
ebullición de su monómero, por lo que se puede separar fácilmente de los
restantes componentes de la fracción C5 por destilación a presión reducida.
El residuo, por calentamiento
a temperaturas superiores a los 200ºC (por ejemplo, 300ºC, reactor tubular,
80-85% rendimiento), se transforma nuevamente en cantidad apreciable en un
monómero que por destilación da ciclopentadieno puro:

Fácilmente y con considerable
desprendimiento de calor se transforma en el dímero. En esta forma se
transporta y conserva.
El ciclopentadieno se ésta
empleando cada vez más en la fabricación de resinas de hidrocarburos. Bien se
copolimeriza con los otros componentes de la fabricación de craqueo C5
(pentanos, pentenos, isopreno, piperileno), con lo que se obtiene la resina de
farcción C5 o bien el dímero puro disuelto en un disolvente
aromático y calentado a 250-280ºC se polimeriza a policlopentadieno que
eventualmente se estabiliza por hidrogenación. Se puede también copolimerizar
catiónicamente. Los polímeros se utilizan como constituyentes de pegamentos de
fusión o de adhesión, y como resinas para tintas de imprenta. Productores de
resinas de HC-C5 importantes en Europa son la Exxon y la ICI, que en
conjunto tienen una capacidad de producción anual de unas 45 000 toneladas.
El ciclopentadieno se sigue
empleando en las reacciones Diels-Alder; así el 5-etilidennorborneno se puede
obtener en una reacción en dos etapas de butadieno y clopentadieno.
Primeramente se forma el 5-vinilbiciclo- [2,2,1] hept-2-eno, que con catalizadores de metales alcalinos se
isomeriza a 5-etilidenbiciclo- [2,2,1] hept-2-eno (o sea, 5-etilidennorborneno):
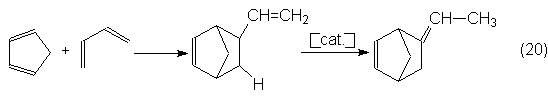
El 5-etilidennorborneno se
añade, en pequeñas cantidades, como tercomponente a la polimerización de
etileno-propileno.
El terpolímero resultante se
puede vulcanizar en las condiciones ordinarias para obtener el denominado EPDM
(hule etileno-propeno-dieno tipo polimetileno).
Otros ejemplos industriales
de reacción Diels-Alder empiezan con el importante producto intermedio
hexacloro-ciclopentadieno, que se obtiene de la cloración del ciclopentadieno
en varias etapas.