Olefinas
(Ir a página principal http://organica1.org/ )
1 Desarrollo histórico
de la química de las olefinas
2 Olefinas por escisión
de hidrocarburos
3 Procesos especiales de
obtención de olefinas
3.3.1 Olefinas
superiores no ramificadas
3.3.2. Olefinas
superiores ramificadas
1 Desarrollo
histórico de la química de las olefinas
El desarrollo de la química de las olefinas después de la Segunda Guerra
Mundial está estrechamente unido al ciclónico impulso de la petroquímica.
La química del alquitrán y del acetileno, que por esos tiempos dominaba
especialmente en Alemania, había proporcionado una multiplicidad de
disolventes, sustancias para lacas, elastómeros, durómeros, termoplásticos y
fibras sintéticas. La ampliación a producción en gran escala sólo pudo hacerse,
sin embargo, con la introducción de la química de las olefinas y con el
desarrollo de los procesos para el mejoramiento de las mismas y polimerización
de las olefinas y de los monómeros de base olefínica.
El florecimiento de la química de las olefinas en los EE.UU. fue secundado
por el rápido desarrollo de la motorización. En los años treinta se desencadenó
una demanda tal de combustibles, que las refinerías tuvieron que recurrir a
obtener cantidades adicionales de gasolina para coches por procesos térmicos de
disociación de las fracciones de alta temperatura de ebullición. Por ello,
aparecieron las olefinas como subproductos, que al principio sólo se utilizaron
para la obtención de bencina por polimerización y alcoholización y con ello una
mejora de las cualidades de la gasolina.
Hacia 1948 llegó también este impulso a Alemania, de forma que la creciente
capacidad de las refinerías proporcionó las materias para la obtención de
olefinas.
Paralelamente se desarrollaron nuevos métodos de obtención de monómeros de
las olefinas y el perfeccionamiento de
su polimerización, sin los cuales no hubiera sido posible el rápido crecimiento de la química de las olefinas.
2 Olefinas por
escisión de hidrocarburos
Las olefinas son sustancias reactivas que se encuentran en el gas natural y
en el petróleo, aunque sólo en pequeñas cantidades. Se tienen que obtener por
determinados procesos de escisión o de craqueo.
La técnica de las refinerías gira
en torno a satisfacer las demandas del mercado con la diversidad de productos
que se pueden obtener principalmente del petróleo natural por los tres tipos de
procesos de transformación: los catalíticos, los catalíticos hidrogenantes, así
como los de craqueo térmico.
El craqueo catalítico sirve para transformar por diferentes formas de
procesos las fracciones de destilación de temperaturas de ebullición elevadas
en parafinas saturadas ramificadas, así como naftenos y aromáticos. La parte de
olefinas es relativamente pequeña, así que el craqueo catalítico se aplica
preferentemente a la obtención de carburantes. Como catalizadores de craqueo se
prefieren los silicatos de aluminio con
aditivos activantes de Cr2O3 (TCC-catalizador =
thermoforming catalytic craking - Proceso de la Movil Oil) o MnO (catalizador
Houdry). En las nuevas instalaciones se emplean silicatos alumínicos
cristalinos en forma de zeolitas, bien sea en sus formas protónicas o
intercambiadas con tierras raras. Los catalizadores de zeolita se distinguen
por elevar el rendimiento en bencina y disminución del depósito de cock. Puesto
que en todos los procesos de craqueo el catalizador se inactiva al cabo de
algún tiempo a causa de la deposición sobre el mismo de cock, se le debe
regenerar continuamente por combustión del cock depositado. Las condiciones
generales del proceso son unos 450-500ºC y una pequeña sobre presión de aire.
Los catalizadores de zeolita impregnados de tierras raras se distinguen por su
gran estabilidad térmica.
En el hidrocraqueo o craqueo catalítico en presencia de hidrógeno, además
de fracciones de elevado punto de ebullición, también los residuos pueden
transformarse por diferentes procesos en productos volátiles ligeros. La
composición del producto depende del
material de partida, del tipo de catalizador empleado y de las condiciones del
proceso y se puede orientar hacia la obtención de LPG (liquefied petroleum
gas), i-butano, gasolina, hafta hasta fueloil, respectivamente, por orden de
preferencia. Es característica de este proceso de craqueo la ausencia de
olefinas en el producto. Como catalizadores se emplean sistemas bifuncionales
de hidrogenación deshidrogenación metálicos (por ejemplo, Co-Mo o Pd-Pt) y
componentes ácidos para craqueo (por ejemplo, Al2O3. SiO2
y también en forma de zeolitas) en presencia de hidrógeno. Las condiciones el
proceso con 270-450ºC y 80-200 bars exigen relativamente altos costos de
inversión. Además, hay que añadir 300-500 m3 de hidrógeno por
tonelada de aceite de partida que hay que proporcionar por procesos de
obtención especiales, ya que sus necesidades no se pueden cubrir con el de la
refinería.
La principal fuente de olefinas en
la actualidad es el craqueo térmico. Se trata de una disociación radicálica de
los hidrocarburos, que se realiza en su mayoría bajo presión y a temperaturas
de unos 400-500ºC. Los principios de un proceso de craqueo se pueden explicar
tomando como ejemplo el curso del n-octano de la forma siguiente: la
disociación térmica empieza con la homólisis de un enlace C - C con formación
de dos radicales libres:
![]()
Ambos alcohil radicales pueden ahora sustraer un átomo de hidrógeno de otra
molécula de n-octano y con ello se produce un nuevo radical y un alcano de
cadena más corta:
![]()
La sustracción de hidrógeno ocurre preferentemente en un átomo de C
secundario -y en todos los átomos de C secundarios con la misma probabilidad -
puesto que los átomos de H en carbonos secundarios tienen una energía de enlace
inferior a la C - H de los grupos CH3. Ambos radicales originarios o también el
n-octil pueden también experimentar una b escisión y dar origen a etileno y, respectivamente, propeno y un radical
alquilo de cadena más corta:
![]()
Los procesos de disociación incluyen pues variaciones en el contenido de H2
y del esqueleto carbonado. Entre las primeras cuentan la deshidrogenación y la
transferencia de H2 de las fracciones de hidrocarburos ricos en H2
(volátiles) y a las segundas pertenece la escisión de cadenas procedentes de
las fracciones más pobres en hidrógeno y de mayor peso molecular.
A las variaciones del esqueleto carbonado corresponden no sólo los
acortamientos de cadena, sino también
la isomerización y ciclación, así como reacciones secundarias, tales como la
polimerización de olefinas, alcohilación y condensación de los aromáticos para
dar productos polinucleares.
Desde el punto de vista termodinámico, todos los hidrocarburos saturados e
insaturados pueden considerarse inestables respecto a sus elementos a las temperaturas empleadas en la industria
para la escisión de los mismos. Esto significa que en una reacción de pirólisis
al alcanzar el equilibrio termodinámico se produciría la completa descomposición
del hidrocarburo en carbono e hidrógeno.
El fin, pues, de un proceso de craqueo a escala industrial es proporcionar
grandes cantidades de energía a un nivel elevado de temperatura dentro de un
tiempo suficiente para que el producto se descomponga en sus elementos.
El óptimo de la disociación de hidrocarburos viene determinado por tres
parámetros que influyen en la cinética;
·
Temperatura final de disociación.
·
Tiempo de permanencia.
·
Presiones parciales de los
hidrocarburos.
Paso 1:
La temperatura influye en la composición del gas de disociación; a unos 400ºC las cadenas de carbonos se encienden preferentemente por la mitad; al aumentar la temperatura la escisión se desplaza hacia los extremos, es decir, con formación de olefinas de poco peso molecular. Además, como consecuencia de una gran concentración de radicales a temperatura alta, se eleva la velocidad de craqueo.
Paso 2:
El tiempo de permanencia influye, para temperatura de
disociación constante, en la proporción de productos primarios a productos
secundarios.
Con tiempo de permanencia corto predominan las reacciones
primarias que proporcionan olefinas; para tiempos largos, aumentan las
reacciones secundarias como oligomerizaciones y separación de cock.
Paso 3:
La presión parcial de los hidrocarburos tienen un efecto
decisivo sobre la reacción de disociación, la cual transcurre con un aumento
del número de moles; una presión parcial alta favorece las reacciones de
polimerización y condensación y una presión parcial baja mejora el rendimiento
en olefinas. Para disminuir la presión parcial de los hidrocarburos, se mezcla
un gas extraño, generalmente vapor de
agua, a la fracción de HC (hidro carburos)que se piroliza (disociación con
vapor o Steamcracking). Al aumentar el contenido de vapor de agua se aumenta el
rendimiento en olefinas y se disminuye simultáneamente la separación de cock.
En resumen, teniendo en cuenta los tres efectos variables
mencionados, resulta que la obtención de olefinas de peso molecular bajo se
favorece cuando el proceso térmico de disociación se realiza a alta
temperatura, corta permanencia y presión parcial baja.
La escisión de hidrocarburos con vapor tiene dos formas
de proceso resultantes desde el punto de vista de la intensidad del craqueo
(severity):
1. El craqueo de baja intensidad (low severity) a menos
de 800ºC, con una permanencia de 1 segundo.
2. El craqueo de alta intensidad (high severity) casi a
900ºC, con una permanencia de unos 0,5 segundos.
Con estas variantes es posible influir en la distribución proporcional de olefinas
C2-C3-C4.
3 Procesos
especiales de obtención de olefinas
3.1. Etileno,
propileno
Etileno y propileno son, en la actualidad, ponderalmente las sustancias
fundamentales más importantes de la Química Orgánica. Así, el etileno es el
producto básico de partida para alrededor de un 30% de todos los productos
petrolquímicos.
Las cantidades de producción de etileno y propileno en los principales
países industriales se resumen en la tabla al margen (conocidos hasta ahora).
En años venideros se prevé que la tasa de crecimiento será mayor para el
propileno que para el etileno, ya que un mayor empleo de hidrocarburos de
temperatura de ebullición alta en los procesos de disociación desplaza a favor
del propileno la proporción de olefinas producidas. El etileno originariamente
se obtenía por hidrogenación parcial de acetileno procedente de carburo, por
deshidratación de etanol o por aislamiento del gas de cockerías. Estos
procedimientos no tienen importancia en la actualidad en los países en donde se
ha desarrollado la petroquímica. No obstante, en países en vías de desarrollo,
como los de América del Sur, Asia y África , con producción de etanol por
fermentación, el proceso de su deshidratación puede también utilizarse para
completar las necesidades de etileno producido por medios petrolquímicos. El
propeno ha empezado a desempeñar un papel importante en la industria química
desde que se puede obtener a partir de
las fracciones del crudo y del gas natural.
Actualmente se dispone en grandes cantidades de ambas olefinas a partir de
la disociación térmica de hidrocarburos saturados. Las instalaciones de
disociación para etileno y propileno alcanzan actualmente capacidades de casi
600 000 toneladas año de etileno (desde
1976 en Arco, en Texas) y sobre las 300 000 toneladas año de propeno.
Tabla 1. Materias primas para obtención de
etileno (en peso %).
|
Materia prima |
Europa 1975 |
occ. 19851) |
EE.UU. 1975 |
Mundo 1975 |
|
Gas de refinería |
1 |
3 |
8 |
4 |
|
LPG2), etano propano |
1 |
3 |
65 |
23 |
|
Nafta |
88’ |
75 |
1 |
56 |
|
Gasoil |
0 |
22 |
3 |
1 |
|
Otras y variadas materias primas |
10 |
|
23 |
16 |
1) previsible 2)
liquefied pretoleum gas = gas de petróleo licuado
En EE.UU. la materia prima dominante para la obtención de olefinas C2/C3
es el gas natural rico en etano, propano y butano (llamado gas natural <<húmedo>>), así como los gases de refinería.
Allí se encuentran en cantidad muy abundante y proporcionan por craqueo
catalítico (FCC = fluid catalytic craking), preferido en EE.UU., altos
rendimientos en etileno. La producción de propileno es comparativamente menor.
Así, en 1975, en EE.UU. un 65% de la producción total de etileno se obtuvo de
gas de petróleo licuado y gases de refinería. De todas formas este componente
va disminuyendo claramente con el creciente empleo de nafta y gasoil.
En Europa occidental falta hasta ahora gas natural rico en etano y las
futuras cantidades disponibles de gas natural procedentes del Mar del Norte son
relativamente pequeñas, así pues, igual que en Japón y otros países, la nafta
de 200ºC de ebullición final es la materia prima a disposición más barata que
se puede dedicar a la disociación.
En 1975, el 88% del etileno producido en Europa occidental se obtuvo a
partir de nafta. El consumo total de la industria química de Europa occidental
alcanzó en ese tiempo 42 millones de
toneladas año y se calcula su crecimiento para 1980 a unos 65 millones de
toneladas año. Para ampliar la base de materias primas , tanto en EE.UU. como
en Europa occidental, se están desarrollando procesos que utilicen fracciones
del petróleo de punto de ebullición más alto, como, por ejemplo, gasoil de
temperatura de principio de ebullición
superior a 200ºC para ser
empleada en la disociación con vapor (ver apartado 1.4.1). Esta tendencia se
puede ver claramente en la estadística de las instalaciones proyectadas; así,
para 1985, la porción de etileno a partir de nafta descenderá a un 75%. Y en
cambio la procedente de gasoil aumentará al 22%. Sólo un 3% se obtendrá de gas
natural o de gas de petróleo.
Un nuevo método de producción de etileno se tendrá con el
perfeccionamiento de los procesos
desarrollados por Kureha Chem. Ind. Propuesto por UCC. Según éste se utilizará
petróleo bruto desasfaltado para disociarlo
en un reactor de craqueo especial por oxidación parcial en presencia de
vapor de agua a temperatura de hasta 2000ºC. Frente a los procesos
convencionales en dos etapas (refinería de petróleo y craqueo con vapor), con
un rendimiento en etileno y otros productos valiosos del 40%, con este
procedimiento, de una sola etapa, se debe alcanzar un rendimiento de hasta un
60-70%, cuyo porcentaje en etileno sería de un 33%. El reactor prototipo, una
instalación piloto, debe ponerse en funcionamiento en 1979; la instalación
comercial no podrá realizarse antes de la mitad de los años ochenta. Dow ha
anunciado también la construcción de una planta piloto fundada en un principio
muy semejante.
El modo de trabajo de la disociación de nafta se divide en los siguientes pasos:
·
Disociación de la nafta en hornos
tubulares.
·
Templado, es decir, enfriamiento
brusco.
·
Compresión de los gases de disociación
y purificación.
·
Secado, enfriamiento y destilación a
baja temperatura.
Paso 1:
La nafta, previamente vaporizada, se introduce junto con
vapor de agua sobrecalentado, en los tubos de unos 50-200 m de largo y de
80-120 mm de diámetro del horno de disociación. Los tubos de cromo-níquel se
disponen verticalmente en los modernos hornos de craqueo de alta intensidad
(High Severity). Se calientan directamente por combustión de gases o aceites a
unos 1050ºC en sus partes más calientes.
Paso 2:
Los productos de disociación salen del espacio en que ésta se produce a unos 850ºC y tienen que enfriarse rápidamente a unos 300ºC (templado) para evitar reacciones subsiguientes. Primeramente se realiza esto en forma indirecta, con producción de vapor, por templado en los refrigerantes y, finalmente, por aceite pulverizado.
Paso 3:
En esta fase se separan el agua utilizada en el proceso y
la bencina de pirólisis y se comprimen los constituyentes gaseosos en el
compresor de gas bruto para su purificación haciéndolos pasar por un baño
alcalino, por ejemplo de sosa cáustica al 5-15% que separa el H2S y
el CO2.
Paso 4:
Antes de proceder a la propia elaboración se debe
realizar un cuidado desecado para que en la subsiguiente destilación a baja
temperatura no haya perturbaciones por formación de hielo. El gas bruto seco se
enfría en varios pasos y se somete a destilación fraccionada en un sistema de
columnas.
Después de su separación, el etileno contiene aún
acetileno y etano. El acetileno perturba la polimerización del etileno y se
tiene que separar, bien por hidrogenación catalítica selectiva, bien por
destilación extractiva, por ejemplo, con dimetilformamida o-N-metilpirrolidona.
La separación final de etileno/etano requiere, a causa de sus temperaturas de
ebullición muy semejantes, unas columnas de eficacia muy grande. El etileno que
se obtiene es de una pureza del 99,95%
(grado de pureza para polimerización).
En forma análoga, después de separar los componentes de
la fracción C3 y antes de aislar propileno/propano hay que realizar
la hidrogenación catalítica selectiva de las porciones de alleno y propino en
propano y propeno, respectivamente. El propileno se puede aislar con una pureza
del 99,9%.
Además, en la disociación de nafta se producen fracciones
C4 y C5 que sirven como productos de partida para la
obtención de olefinas superiores (ver apartado 3.3.2). así como bencina de pirólisis que es materia
prima para la obtención de aromáticos (ver apartado 12.2).
La tabla siguiente nos da una distribución de productos
típica, como la que se obtiene en la disociación de nafta con vapor en
condiciones de High Severity, cuando se reciclan el etano y el propano:
Tabla 2 Distribución de productos en proceso
High-Severity de disociación de nafta con vapor.
|
Producto |
Peso % |
|
Gas residual (CH4, H2) |
16.0 |
|
Etileno |
35.0 |
|
Propileno |
15.0 |
|
Fracción C4 |
8.5 |
|
Fracción C5 y fracciones superiores |
25.5 |
|
(Bencina de pirólisis, aceite residual) |
|
Las proporciones industrialmente más importantes de olefinas C2-C3-C4
se pueden influir no sólo por la intensidad del craqueo (las condiciones de Low
Severity aumentan la parte de olefinas superiores), sino que también se pueden
acoplar a un <<Proceso-Triolefina>> (Ver apartado 4).
El etileno en todos los países industriales se dedica predominante a la
polimerizatión. En el caso del propileno su empleo para polipropileno es
significativamente menor. La tabla al margen da - por cuanto se sabe - una
visión de los componentes poliolefínicos (polietileno = PE, polipropileno = PP)
en la producción de olefinas en algunos de los países industriales más
importantes. Las demás conclusiones sobre utilización se darán en el apartado 7
para el etileno y en el apartado 11 para el propileno.
3.2. Butenos
Los butenos se obtienen en las refinerías en la producción de carburantes y
en los diferentes procesos de craqueo de butano, nafta o gasoil, necesariamente
como subproducto en grandes cantidades. Por ello, los antiguos procesos de
obtención, como a partir de butanoles o de acetileno, han perdido actualmente
interés.
También el proceso triolefina de Phillips, en el cual por
desproporcionamiento de propileno se obtienen, además de etileno, los
n-butenos, se suspendió por razones económicas después de haber estado
funcionando durante nueve años por su único usuario, la Shawinigan, en Canadá.
Una de las materias primas más importantes en Europa occidental para
obtener butenos es la fracción C4 de la disociación de nafta, que en
total representa como el 8-9% del producto total disociado y como el 40% de la
producción de butenos. En los EE.UU., por el contrario, los procesos de
refinería de craqueo catalítico y de reformado proporcionan la mayor cantidad
de butenos; menos del 10% procedían en 1978 de la disociación de nafta. Este
porcentaje, en efecto, aumentará en los años próximos, pero no se duplicará
antes de los años noventa.
Desde que se consiguió la separación de los componentes de la fracción C4
en sus componentes puros a nivel industrial, han recibido un gran impulso los
procesos químicos para el aprovechamiento del buteno.
La cantidad absoluta de fracción C4
y su composición están influidas principalmente por dos factores que intervienen en el proceso de la
disociación con vapor de los hidrocarburos:
·
La clase de los productos empleados y
·
La intensidad del craqueo.
Paso 1:
Con crecientes puntos de ebullición de las fracciones de
refinerías, es decir, pasando de nafta ligera a nafta pesada y a gasoil, va
disminuyendo la fracción de C4.
Paso 2:
Al aumentar la intensidad de craqueo disminuye también la
cantidad total de fracción C4; sin embargo, aumenta el contenido
relativo de butadieno a causa de su mayor estabilidad (ver tabla 3).
Tabla 3. Composición de una fracción de C4
en diferentes condiciones de craqueo (en peso %)
|
Productos disociados |
Baja intensidad |
Alta intensidad |
|
1,3-butadieno |
26 |
47 |
|
i-buteno |
32 |
22 |
|
1-buteno |
20 |
14 |
|
trans-2-buteno |
7 |
6 |
|
cis-2-buteno |
7 |
5 |
|
n-butano |
4 |
3 |
|
Vinilacetileno |
0,2 |
2 |
|
Residuo: i-butano,etilacetileno y 1,2-butadieno |
|
|
La fracción C4 no se puede separar económicamente en sus componentes
por simple destilación fraccionada debido a la gran proximidad de sus puntos de
ebullición. Por tanto, sólo se puede emplear procesos de separación físicos más
efectivos y selectivos, y, además, también procesos químicos. La elaboración de
la fracción C4 comienza con el aislamiento del butadieno, que se
desribe en el apartado 5.1.2. Después
de la extracción de la mayor parte y la eliminación del butadieno residual, por
ejemplo, por hidrogenación selectiva (<<Hidrogenación en frío BAYER>> o hidrogenación selectiva según JFP),
se obtiene una mezcla cuyos componentes
principales son i-buteno, n-butenos y butano, que se denomina refinado C4
y que posee la siguiente composición típica:
Tabla 4 Composición típica de un refinado C4.
|
Componentes |
Vol.-% |
|
i-buteno |
44-49 |
|
1-buteno |
24-28 |
|
2-buteno
(cis + trans) |
19-21 |
|
n-butano |
6-8 |
|
i-butano |
2-3 |
En ulteriores separaciones del refinado C4 se aisla primeramente
i-buteno, el cual por su ramificación y alta reactividad se diferencia de los
demás componentes C4.
El proceso por tamiz molecular , por ejemplo, el proceso <<Olefin-Siv>> de UCC, utiliza el hecho de que el
grupo lateral metilo hace al i-buteno demasiado voluminoso para su adsorción en
los poros del tamiz molecular de dimensiones muy uniformes entre 0,3 y 1 mm
(3-10 A). Sólo los n-butenos y el butano se adsorben y por medio de un hidrocarburo de ebullición alta se les puede desorber o liberar de nuevo. En
esta forma, a partir del refinado C4 es posible alcanzar un i-buteno
de una pureza del 99%.
La alta reactividad relativa del i-buteno se aplica para su separación
química. Prácticamente han dado resultado tres procesos:
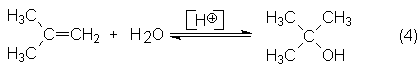
1. Hidratación de i-buteno en presencia de ácido mineral diluido con
formación de ter-butanol y su consiguiente desdoblamiento de nuevo en i-buteno
y agua:
2. Oligomerización del i-buteno por catálisis ácida preferentemente a
di-i-buteno, es decir, una mezcla de isómeros en el doble enlace del
2,4,4-trimetilpenteno:
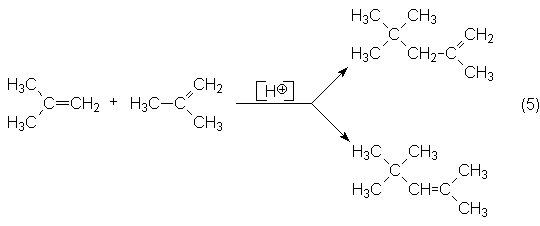
Se puede adicionar otra molécula de isobuteno para obtener tri-i-buteno y
oligómeros superiores.
3. Polimerización del i-buteno en presencia de un catalizador ácido de
Lewis para obtener poli-i-buteno:
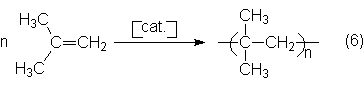
El producto de partida para estos tres procesos es el refinado C4,
del cual se extrae el i-buteno por su reactividad y luego se purifica empleando
la ruta 1. Según la ruta 2 se
oligomeriza irreversiblemente y por la ruta 3 se polimeriza irreversiblemente.
En la realización industrial de la hidratación del i-buteno las empresas
BASF, CFR-Badger, Esso, Huls, Petrotex y
Scientific Design utilizan
sulfúrico del 50-60%. A partir del refinado C4 se extrae el i-buteno
en contracorriente, en forma de ter-butanol que se libera a 10-20ºC. El
ter-butanol, después de diluirlo con agua, se destila al vacío y separado así
de la disolución ácida, se desdobla de nuevo a isobuteno.
La Nippon Oil realiza la hidratación del i-buteno con disolución acuosa de
HCI en presencia de una sal metálica. De esta forma se obtiene, por la
extracción del refinado C4, una mezcla de ter-butanol y cloruro de
ter-butilo, que pueden ser ambos disociados a i-buteno.
La oligomerización del i-buteno se realiza por catálisis protónica a
temperaturas de unos 100ºC.
Segúnun proceso desarrollado por Bayer con un catalizador cambiador de
iones ácido a 100ºC y aproximadamente 20 bars, en fase líquida, se produce una
fuerte reacción exotérmica y el i-buteno se transforma en dímero y trímero en
un 99%, con un reparto de 75% de dímeros y 25% de trímeros. Por centrifugación
se separa el catalizador de la mezcla y por destilación de ésta los n-butenos y
las olefinas C8 y C12. El contenido de isobuteno del
n-buteno se reduce así a aproximadamente un 0,7% en peso. La ventaja del
proceso reside en la sencillez de su tecnología; la desventaja es la
isomerización de los dobles enlaces que se produce simultáneamente de buteno-1
a buteno-2, y que en los procesos de hidratación ocurre en mucha menor cuantía.
Un ejemplo de gran instalación para producir la oligomerización de
i-buteno, como método para su separación y aplicación, es la instalación de la
EC-Dormagen con una producción de 90
000 toneladas al año, que desde hace algunos años funciona con un proceso
desarrollado conjuntamente por Bayer y BP.
La polimerización del i-buteno, por ejemplo, según el proceso Cosden, se realiza
en fase líquida con AICI3 como catalizador. Se obtiene poli-i-buteno
con pesos moleculares comprimidos entre 300-2700. Sólo una pequeña parte de
n-buteno se copolimeriza
simultáneamente.
Después de la separación del i-buteno, la fracción C4 residual
contiene, junto a los n-butenos, solamente n- e i-butano. Una nueva separación
no tiene sentido en general, puesto que los hidrocarburos saturados en algunas
de las posteriores transformaciones de los butenos, por ejemplo, en la
hidratación a butanoles, permanecen inalterados y, por lo tanto, se separan
como productos inertes. En principio, es posible una separación de buteno-2
(cis y trans) de buteno-1 por destilación, así como de butanos (n- e I-) y
n-butenos por destilación extractiva.
Nuevos perfeccionamientos desarrollados, sobre todo en los EE.UU., han
conducido a una diferente elaboración de la fracción C4. Según
éstos, el refinado libre de butadieno, que sobre todo contiene i-buteno y
n-butenos, se isomeriza catalíticamente. Para ello se utilizan catalizadores de
Pd modificados en presencia de H2, como en el proceso UOP en
la fase gaseosa o según el proceso JFP en la fase líquida, para transformar el
1-buteno en 2-buteno.
Las diferencias de puntos de ebullición entre el i-buteno y el 2-buteno son
suficientemente diferentes ahora (ver apartado 5.1.2) para separarlos por
destilación fraccionada. Las primeras empresas que han adoptado esta nueva
forma de elaboración de la fracción C4 son la Phillips Petroleum y la
Petro-Tex, ya que permite, simultáneamente, emplear el 2-buteno para obtener
bencina alcohilada, que posee un índice
de octano superior a la que se obtiene por empleo de i-buteno.
Todos los butenos son valiosos productos de partida para síntesis
industriales.
El i-buteno se transforma preferentemente para carburantes con alto índice
de octano, como bencina de polimerización y bencinas alcohiladas. Para ello,
principalmente se dimeriza a di-i-buteno y, finalmente, se le hidrogena o se le
hace reaccionar con i-butano para alcohilación del mismo. El i-buteno y el
di-i-buteno se emplean también para alcohilar aromáticos.
Los butenos se emplean además como productos de partida de polímeros y
copolímeros, como i-buteno para el poli-i-buteno (Oppanolâ), i-buteno junto con isopreno para
la obtención de butil-caucho (ver apartado 5.1.4). 1-buteno para polibuteno
isotáctico, así como, junto con etileno, para copolímeros etileno/1-buteno.
Como reacciones más importantes para obtener derivados de los butenos, como
productos químicos intermedios, están la hidratación a alcoholes (n-buteno -
butanol secundario, isobuteno - ter-butanol, ver apartado 8.1.3), la
hidroformilación para la obtención de aldehídos y alcoholes C5 (ver
apartado 6.1), la oxidación de n-buteno a anhídrido maleico (ver apartado
13.2.3.2.), la adición de metanol al i-buteno que da metil-ter-butil éter (ver
apartado 2.3.1.2) y la degradación oxidante de n-butenos a acético (ver
apartado 7.4.1.2), De menor importancia
son la amonoxidación de i-buteno a metacrilonitrilo (ver apartado 11.3.2) y la
oxidación de i-buteno a ácido
metacrílico (ver apartado 11.1.4.2). La deshidrogenación de n-butenos a
butadieno se ve en el apartado 5.1.3 y la transformación de i-buteno en
isopreno en el apartado 5.2.2.
3.3 Olefinas
superiores
En las olefinas con número de
átomos de carbono superior a cuatro aumenta rápidamente el número de isómeros.
Así, las mezclas como las que se producen en los procesos de craqueo no se
pueden desdoblar en sus componentes
técnicamente. Además, sólo algunos componentes concretos tiene interés
industrial. Así, de los componentes de la fracción C5 de la
disociación de nafta, que principalmente son n-pentano, i-pentanos, n-pentenos,
i-pentenos, isopreno, ciclopenteno, ciclopentadieno y pentadieno, sólo se
aislan en gran cantidad el isopreno
(ver apartado 5.2.1) y el ciclopentadieno (ver apartado 5.4).
De las olefinas inmediatamente superiores -con importancia técnica hasta C18
- con los procesos de obtención de olefinas no ramificadas, sólo se pueden
obtener mezclas de homólogos, es decir, fracciones de olefinas como, por
ejemplo, C6 - C9, C10 - C13 Y C14
- C18. En todo caso la posición del doble enlace en las olefinas no
ramificadas depende, en gran parte, del tipo de proceso en que se han obtenido.
Por el contrario, las olefinas ramificadas pueden obtenerse de forma dirigida,
es decir, con un número de isómeros limitado.
Se pueden diferenciar por ello las olefinas superiores en dos grupos
principales, Las no ramificadas y las ramificadas.
Las olefinas primeramente mencionadas de cadena normal o lineales han
adquirido en los últimos tiempos un gran interés, ya que sus productos de
transformación, a causa de su linealidad, presentan especiales ventajas, como,
por ejemplo, su degradabilidad biolólogica.
3.3.1 Olefinas
superiores no ramificadas
Este grupo de olefinas superiores no ramificadas, normales o lineales como
se las denomina , puede subdividirsepor la posición del doble enlace, según que
esté en un extremo (terminal) o en el interior (internas).
Las olefinas terminales o a-olefinas son obtenibles en principio por dos
procesos:
·
Por una definitiva oligomerización
de etileno por reacción de síntesis, que forma las denominadas olefinas
de Ziegler o por medio de una nueva variante con catalizadores mixtos,
organometálicos.
·
Por deshidrogenación de n-parafinas por diversos métodos.
Paso 1:
La obtención de a-olefinas según Ziegler (proceso Alfen)
consiste en una reacción de crecimiento, dirigida de etileno en presencia de
trietilaluminio, que transcurre en dos etapas:
En la primera tiene lugar una reacción de síntesis a
temperatura baja de 90-120ºC y a unos 100 bars, intercalando etileno en
trietialuminio con crecimiento de las cadenas alcohílicas unidas al aluminio. Con ello se forma una
mezcla de trialcohilaluminio con cadenas largas, según el siguiente esquema:
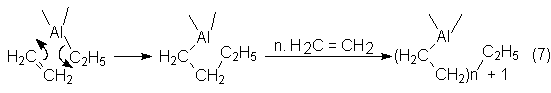
La segunda es una
reacción de desplazamiento a más alta temperatura, 200-300ºC, y menor presión ,
50 bars; se desengacha una mezcla de oligómeros de etileno con recuperación del
catalizador libre:

Los grupos alcohilos se desprenden en forma de a-olefinas
de cadena lineal con número par de carbonos y, puesto que no puede producirse
isomerización, se les obtiene en un alto grado de pureza. Por ello, la
obtención de las olefinas de Ziegler en su primer paso es una reacción de
formación análoga a la síntesis-alfol (ver apartado 8.2.2). Ambos procesos
tienen como producto intermedio el compuesto no aislado AI[CH2CH2)n-C2H5]3. La cantidad este quiométrica de trietilaluminio empleada se recupera por
un proceso adicional para utilizarla de nuevo.
La obtención industrial de a-olefinas, como hemos dicho,
puede hacerse en dos pasos, es decir, la reacción de formación por una parte y
terminando con <<el desenganche a alta temperatura y
corto tiempo>>. Se puede combinar adicionalmente la
reacción de formación con una transalcohilación, que da mayor proporción de
olefinas C12 - C18,
que son importantes para la preparación de alcoholes (ver apartado 8.2.2).
La obtención de a-olefinas puede también realizarse en
un solo paso, <<la oligomerización de etileno a alta
temperatura>>, en el que a unos 200ºC y 250 bars se
cataliza la reacción con trietilaluminio (cerca de un 0.5% en peso).
Intencionalmente se limita la transformación del etileno para obtener en su
mayor parte a-olefinas sin ramificaciones. El catalizador, después de la
reacción , se destruye por hidrólisis alcalina y queda en la mezcla de olefinas
resultante. Otra característica del proceso en un solo paso es que en
comparación con el de dos pasos es mucho más amplio el número de átomos de
carbono de las cadenas carbonadas desde C4 hasta C30 en
la mezcla de olefinas obtenidas.
Tabla 5. Distribución de a-olefinas en la
oligomerización del etileno (en %).
|
a-olefinas |
Proceso a alta temperatura |
Proceso a baja temperatura |
|
C4 |
5 |
5 |
|
C6 - C10 |
48 |
50 |
|
C12 , C14 |
20 |
30 |
|
C16, C18 |
13 |
12 |
|
C20, >C20 |
14 |
3 |
En ambas variantes del proceso las mezclas de a-olefinas
se puede someter a destilación para separarlas en las fracciones deseadas.
El proceso en dos pasos ha encontrado aplicación
industrial en la Ethyl Corporation en los EE.UU. (capacidad en 1979, 205 000
toneladas al año); el proceso de un paso en la Gulf, también en los EE.UU.
(capacidad en 1979, 60 000 toneladas al año; para 1981, unas 71 000 toneladas),
y en la Mizushima Petrochemical en Japón (capacidad en 1979, 25 000 toneladas
al año).
Otros métodos de obtención de a-olefinas se basan también
en el etileno como materia prima, pero se diferencian notablemente en el
catalizador empleado en la oligomerización del etileno. Así, la Esso ha
desarrollado un nuevo proceso, en el que el etileno se oligomeriza a
o-olefinas, en presencia de un catalizador en disolución compuesto por
alcohilcloruro de aluminio/tetracloruro de titanio a temperaturas entre - 70 y
+ 70ºC en disolventes orgánicos, siendo el producto muy puro sin
ramificaciones. El peso molecular de las olefinas aumentan al crecer la
temperatura de la reacción y disminuir la polaridad del disolvente. Las
a-olefinas están en el margen de C4 a C1000. El grupo
Esso fue en 1975, con su capacidad total anual de 25 000 toneladas, el mayor
productor europeo de olefinas superiores a base de catálisis metalorgánica.
También las empresas Mitsui Petrochemical, con un catalizador mixto que contiene Ti, y la Shell, con catalizadores de un complejo de fosfina-Ni, han desarrollado variantes de la oligomerización de etileno para obtener a-olefinas. El proceso de la Shell se aplica en los EE.UU. desde 1977 en una gran instalación de 200 000 toneladas al año (ver apartado 3.4).
Paso 2:
Para la deshidrogenación hay suficientes n- parafinas mezcladas con parafinas ramificadas en las fracciones denominadas petróleo o aceite Diesel procedentes de los petróleos parafínicos. Constituyen componentes indeseables (alto punto de congelación) que se pueden separar, por ejemplo, por enfriamiento. Para ello, la fracción de aceite se diluye con una mezcla como la de metil-etilcetona y benceno o tolueno, o cloruro de metileno y dicloroetano-1-2 o también en propano licuado a presión, y la disolución diluida se enfría. Así se separa una mezcla cristalina de parafinas cíclicas, ramificadas y no ramificadas, que se filtra. Las no ramificadas, las lineales, se pueden aislar en procesos de adsorción.
Industrialmente se han acreditado principalmente dos procesos:
1. Proceso de adsorción con tamices moleculares, que en su realización
industrial puede hacerse ya sea en fase gaseosa con ayuda de un gas portador,
como N2 o H2, por ejemplo, según BP, Leuna (Parex), UCC
(Isosiv), o en fase líquida, por ejemplo, según UOP (Molex).
En los poros muy uniformes del tamiz molecular se adsorben las n-parafinas
en el dominio preferente de C5 hasta C24, mientras que
las cicloparafinas e i-parafinas no
pueden penetrar en los poros.
Después de la saturación del tamiz molecular, las n-parafinas se desorben
con hidrocarburos volátiles, como el n-pentano, bien por disminución de presión
o por elevación de temperatura y un poco de sobrepresión . La extracción según
el proceso Leuna con una mezcla de NH3/H2O conduce a una
velocidad de desorción relativamente alta.
2. Procesos de cristalización extractiva con urea. Se emplean
preferentemente para separar n-parafinas superiore de C15 hasta C30.
Procesos conocidos son, por ejemplo, el Nurex japonés, en el que por mezcla de
urea sólida con disolución de parafina se produce la formación de cristales, o
el desarrollado en Alemania, el Edeleanu, en el que se utiliza una disolución
acuosa saturada de urea.
A partir de los clatratos cristalinos separados, se obtienen n-parafinas
puras por calentamiento a unos 75ºC, con lo que quedan libres y se aislan. Se
obtienen con un 98 % de linealidad. En Europa occidental existía en 1975 una
capacidad aproximada de producción de n-parafinas de 1,07 millones de toneladas
año, que proceden preponderantemente
(un 63 %) de las instalaciones basadas en el proceso Isosiv. En los EE.UU. la
Continental Oil, Exxon y Shell son las únicas productoras de parafinas y, en
conjunto, producen 0,32 millones de toneladas al año.
Para la transformación ulterior de las n-parafinas en olefinas hay tres procesos industriales eficaces:
·
Craqueo térmico (también craqueo con vapor).
·
Deshidrogenación catalítica y
·
<<Deshidrogenación química>> por cloración y dehidrocloración.
Sólo el craqueo térmico produce a-olefinas; los otros dos dan olefinas con
enlaces dobles en el interior de la molécula.
Paso 1:
Análogamente a como se obtienen olefinas cortas, en el
craqueo con vapor también se obtienen olefinas superiores. Las parafinas
empleadas frecuentemente están compuestas de fracciones céreas (C20
- C30) y, por tanto, este
proceso puede ser designado craqueo de ceras . El craqueo de parafinas se
realiza a temperaturas de 500-600ºC a la presión normal o un poco más elevada
en presencia de vapor de agua y con un tiempo de permanencia relativamente
algo, de 7 a 15 segundos. La transformación se ajusta a un 25%, procurando conservar al máximo la linealidad y que
preferentemente el enlace doble sea terminal, es decir, en posición a. Puesto
que la escisión del enlace C - C térmicamente se puede producir en cualquier
posición de la cadena molecular, se obtiene una mezcla de homólogos de
olefinas, de las cuales un 90-95% son a-olefinas y el resto son olefinas
ramificadas, diolefinas y naftenos. Las olefinas medias y superiores se separan
de los productos gaseosos ligeros y, finalmente, se separan por destilación las
fracciones de valor industrial, tales como C6 - C9, C10-C13
y C14-C18. Son productores de a-olefinas, por el proceso
de craqueo de ceras, la Shell y Chevron, con capacidades de producción de 310
000 y 55 000 toneladas anuales, respectivamente.
Paso 2:
La deshidrogenación catalítica de parafinas ha sido
desarrollada por la UOP y se conoce como <<Proceso Pacol Olex>>, por el cual, las n-parafinas comprendidas
entre C6-C19 se deshidrogenan en fase gaseosa sobre un
catalizador en lecho estático a 400-600ºC en presencia de H2 con
transformación incompleta de parafinas, y se obtienen olefinas, compuestas en
un 90% en peso, aproximadamente, de monoolefinas con enlace doble interior
estadísticamente localizado a lo largo de la cadena. La separación de las
parafinas que no se han transformado tiene lugar por adsorción reversible sobre
adsorbentes sólidos , por ejemplo, tamices moleculares.
En 1977’ estaban en funcionamiento cuatro instalaciones según este principio de
trabajo y otras están en construcción.
Las olefinas así obtenidas no pueden competir en linealidad con las a-olefinas obtenidas
por síntesis de Ziegler u oligomerización de etileno, pero, en cambio, son
mucho más económicas.
Paso 3:
Esta vía consiste en la monocloración de n-parafinas en
fase líquida a 120ºC como reacción radicalaria en cadena con iniciación térmica
y subsiguiente eliminación catalítica de HCI a 250-350ºC con silicato AI o
relleno metálico en columnas de acero:
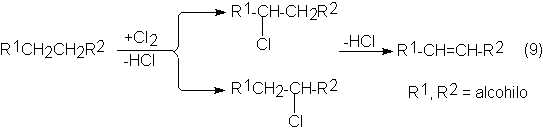
La posición del doble enlace depende de la posición del
átomo de cloro en la parafina; a causa de la mayor reactividad de los grupos CH2
frente a los CH3 el doble
enlace es casi siempre interior. Además, la ulterior cloración de la
monosustitución tiene que limitarse mediante una temperatura baja y
conversiones bajas, a lo sumo un 40%. Este proceso lo siguiente la Hüls con una
capacidad de producción anual de unas 80 000 toneladas. Como material de
partida se utilizan n-alcanos de C10-C13.
Además de las monocloroparafinas utilizadas para la obtención de
n-olefinas, también son de importancia industrial las policloroparafinas con
diferentes contenidos de cloro (15-70 % en peso). Para su obtención se cloran
fracciones de n-parafinas de C10-C30 en reactores de columna de burbujeo a 60-120ºC
y ligera sobrepresión con conversión total de cloro. Las cloroparafinas se usan
como plastificantes para PVC, como materia prima para pinturas, aditivos para
aceites minerales, así como medio de impregnación para el acabado de textiles
resistentes a las llamas e impermeabilización de los mismos. En Europa
occidental se cloraron en 1975 unas 80 000 toneladas de parafinas C11-C18.
Las olefinas lineales tienen usos cuyas características dependen de la
longitud de sus cadenas. Las olefinas C6-C10 se
transforman por hidroformilación e hidrogenación (ver apartado 6.1) en
alcoholes C7-C11 que se emplean como disolventes, o una
vez esterificados con anhídrido ftálico, como plastificantes. Para ello son
igualmente apropiadas las olefinas con enlace doble interior, como las
a-olefinas.
Durante la hidroformilación se produce una isomerización por desplazamiento
del doble enlace hacia el extremo de la cadena, de forma que los aldehídos
obtenidos a partir de a-olefinas y de las olefinas lineales que tienen enlace
doble interno, son prácticamente los mismos. Las olefinas C6-C10
se pueden transformar también en a-olefinoligómeros (AOO), dependiendo de
la clase de catalizador y de las diferentes condiciones de reacción. Son
apropiados como aceites de lubricación de alta calidad. En los EE.UU. funciona
una instalación piloto de Gulf y Mobil Oil, y a principios de 1980 empezará a
funcionar una instalación industrial con una capacidad de producción anual de
16 000 toneladas.
Las fracciones C10 hasta unos C13 se emplean para la
alcohilación de benceno (ver apartado 13.1.4). En presencia de los
catalizadores empleados, ácidos de Lewis o ácidos protónicos (Bronstedt), se
produce simultáneamente a la alcohilación del benceno la isomerización parcial
del doble enlace de la olefina empleada, de modo que el núcleo bencénico se
une a la cadena prafínica
estadísticamente a lo largo de ella. Con esto, los alcohilbencenos lineales (LAB)
(ABL) obtenidos con a-olefinas son semejantes a los obtenidos con olefinas
internas lineales.
Otro modo de obtención de alcohilbencenos lineales consiste en la
alcohilacióndel benceno directamente con cloroparafinas sin la
deshidrocloración inicial de las mismas a olefinas (ver apartado 13.1.4).
Ambos procesos consumieron en 1975 en
Europa occidental unas 303 000 toneladas de n-parafinas, lo que representa el
56% del consumo total de n-parafinas.
También estos alcohilbencenos
secundarios se sulfonan, con lo que se obtienen detergentes anionactivos
biológicamente degradables.
Además, las z-olefinas reaccionan directamente con SO3 y dan
alquensulfonatos (u olefinsulfonatos). En la reacción se forman simultáneamente
sultonas, que se hidrolizan a hidroxialcohilsulfonatos para favorecer su
solubilidad en agua:
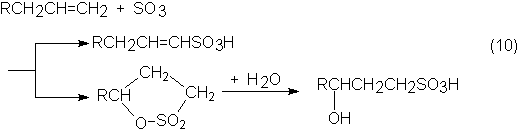
Los alquensulfonatos se obtienen en gran cantidad solamente en la Lion Fat
and Oil Co., en Japón, desde 1968.
Frente a los alcohilsulfonatos los alquensulfonatos tienen una menor
sensibilidad a la dureza. Respecto a degradabilidad biológica y propiedades
limpiadoras, no hay ninguna diferencia.
Los alcohilsulfonatos (o alcansulfonatos), sin embargo, a causa de su menor
coste de obtención a partir de n-parafinas (C12-C18) han
alcanzado mucha mayor importancia como detergentes activos (WAS = waschaktive
Alkylsulfonate). Para su obtención industrial se aplica, generalmente, la
sulfocloración y la sulfoxidación.
En la realización del proceso continuo de sulfocloración las mezclas de
n-parafinas se hacen reaccionar mezcladas con SO2/CI2
bajo la influencia de radiación de lámparas de vapor de mercurio a 20-35ºC, con
lo que se obtienen alcohilsulfocloruros secundarios que seguidamente se
hidrolizan con hidróxido sódico para dar los alcohilsulfonatos
correspondientes:

Para evitar la formación no deseada
de disulfocloruros, se limita la conversión a aproximadamente un 30%.
Las parafinas que no han reaccionado se separan una vez realizada la hidrólisis y después de purificadas se
vuelven a utilizar para la sulfocloración.
La sulfoxidación de mezclas de n-parafinas se hace con una mezcla de SO2/O2
por la acción de luz UV a temperatura de 25-30ºC:
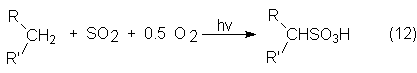
A escala industrial se trabaja según el proceso Luz-Agua de la Hoechst, en
el que de un modo continuo se introduce en la torre de reacción agua junto con SO2, con lo que se produce
como sustancia intermedia el hidroperóxido de alcohilsulfonilo, que se
transforma , finalmente, en ácido alcohilsulfónico y sulfúrico:
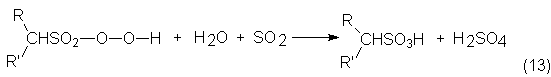
De la disolución acuosa se separa a continuación el ácido alcohilsulfónico
que no es soluble en caliente.
El proceso de sulfoxidación se sigue sólo en Alemania Federal y en Francia,
con instalaciones cada una que producen en conjunto 44 000 toneladas al año.
3.3.2. Olefinas
superiores ramificadas
Las olefinas ramificadas de seis átomos de carbono en adelante se obtienen
preferentemente por oligomerización o cooligomerización de olefinas inferiores,
como propileno, i-buteno y n-butenos. En la tabla siguiente se resumen las
sustancias de partida, los productos de reacción y los procesos de producción:
Tabla 6. Productos empleados y procesos de
preparación de olefinas ramificadas.
|
Materia prima |
Tipo de proceso |
Producto obtenido |
|
Propileno |
Dimerización con AIR3 |
2-metil-I-penteno |
|
Propileno |
Dimerización con metales alcalinos |
4-metil-I-penteno |
|
Propileno |
Tri y tetramerización con H3PO4 |
i-nonenos |
|
Propileno + n-butenos |
Codimerización |
i-dodecenos |
|
i-buteno |
Dimerización preferente con PO4H3/soporte, pero
también |
i-heptenos |
|
|
con cambiadores de iones o con SO4H2 |
Diisobutenos |
Las oligomerizaciones de olefinas, según los catalizadores empleados, se
pueden clasificar en tres grupos principales:
·
Catálisis con ácidos minerales, como H3PO4 o H2SO4, así como con cambiadores ácidos de iones.
·
Catálisis metalórganica con Al-alcohilos y eventualmente con
cocatalizadores.
·
Catálisis metalorgánica con metales alcalinos.
Paso 1:
El proceso de la UOP en que se usa H3PO4/SiO2
en lecho estático está muy extendido industrialmente. Según éste, por ejemplo,
fracciones ricas en propileno, se oligomerizan a 170-220ºC y 40-60 bars con
conversión de un 90% de propileno, formando una mezcla de reacción líquida
constituida principalmente por tri- y tetrapropileno. Ambos productos sirven
particularmente para la alcohilarillderivados han perdido importancia como
materias primas para detergentes, a causa de su difícil degradación biológica
(ver apartado 13.1.4.). El tetrapropileno está encontrando cada vez más
aplicación como olefina para hidroformilación en forma análoga a la del
di-i-buteno que se describe a continuación.
La oligomerización del i-buteno con sulfúrico o
cambiadores ácidos de iones (proceso Bayer), se mencionó ya al tratar de las
transformaciones de la fracción C4 (ver apartado 3.3.2). El
diisobuteno, después de hidrogenado, se emplea como aditivo para carburantes.
Además, es punto de partida para la obtención de i-nonanol por hidroformilación
e hidrogenación, que se emplea para la obtención de plastificantes.
Paso 2:
La dimerización y codimerización de olefinas inferiores
con trialcohilaluminio sólo o con otros
cocatalizadores de la serie de los metales de transición, se diferencian
desde dos puntos de vista: Si se cataliza la reacción sólo con
trialcohilaluminio, se alcanza una gran selectividad. Si además se usa un
cocatalizador, como, por ejemplo, una sal de níquel, aumenta la actividad del
sistema a costa de la selectividad.
Para ambas modalidades se han desarrollado aplicaciones
industriales.
Según el proceso de la Goodyear-Scientific-Design, el
propileno se dimeriza con tripropilaluminio a 200ºC y 200 bars para dar
2-metil-1-penteno, que es un material que se emplea para la obtención de
isopreno (ver apartado 5.2.2).
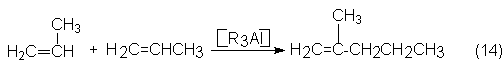
El otro tipo de proceso, llamado <<Dimersol>>, lo ha desarrollado la IFP. Según
éste, se pueden homodimerizar en fase líquida el propileno o el buteno, así
como también codimerizar. Este último proceso se realiza a 60ºC y presión de
unos 18 bars, de modo continuo empleando como catalizador trialcohilaluminio y
una sal de níquel y produce i-heptenos relativamente poco ramificados con una
selectividad del 50%. La poca selectividad no se debe sólo al cocatalizador
empleado, sino también a la <<homodimerización>> de ambos componentes , que se produce
simultánea y estadísticamente. Si se emplea sólo propileno o n-butenos
separadamente en la dimerización, se forman, con gran selectividad (85-92%) y conversión del 90%, i-hexenos e
i-octenos que se distinguen por su escasa ramificación.
De este modo esta variante de dimerización proporciona
i-olefinas C6, C7 y C8 adecuadas, como
productos de aprtida para la obtención de gasolinas de alto octanaje y para la
hidroformilación. Una ramificación a ambos lados del enlace doble de las
olefinas hace que disminuya fuertemente la velocidad de la oxo-reacción.
El método Dimersol ha encontrado en los EE.UU. su primera
aplicación industrial.
Paso 3:
La tercera posibilidad, la dimerización de propano
catalizada por metales alcalinos, sólo ha conseguido hasta ahora una pequeña
importancia industrial. La reacción se realiza a unos 150ºC y 40 bars en fase
líquida y sobre Na/K2CO3 con una selectividad hasta del
80% para dar 4-metil-1-penteno (4MP1):
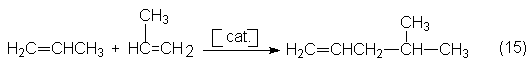
La BP sigue produciendo en una instalación piloto el 4MP1
que, como monómero, sirve para obtener una poliolefina transparente y de alto
punto de fusión (240ºC), que la ICI denomina TPX. La Mitsui Petrochemical ha
puesto en funcionamiento, en 1975, una instalación que emplea el proceso BP y
con una capacidad de 2500 toneladas al año del monómero, que luego transforma
en poli-4-metil-1-penteno.
4. Metátesis de
olefinas
La metátesis de olefinas es una reacción de intercambio, entre dos
olefinas, a través de un estado de transición aun no bien descrito hasta ahora,
en que los grupos alcohilideno se intercambian por disociación y formalmente
sobre el enlace doble. En el caso más simple de metátesis reaccionan dos
moléculas de propileno para dar una de etileno y n-buteno, principalmente,
2-buteno:
![]()
Esta transformación de una olefina de un número de C determinado en otras
dos olefinas, una inferior y otra superior, ha hecho que también se la designe
como desproporcionamiento; sin embargo, la reacción inversa por ser reversible
la metátesis, no queda correctamente expresada con el concepto de
desproporcionamiento.
Las reacciones de metátesis se pueden realizar con sistemas catalíticos,
predominantemente a base de molibdeno, wolframio o renio. Para formarlos se
añaden sus halogenuros o carbonilos solubles en la fase líquida, que pro la
presencia simultánea de combinaciones organometálicas son reducidos a un grado
de valencia inferior y por medio de promotores oxigenados se activan. Se puede
también realizar en fase gaseosa, pero entonces se prefiere emplear los metales
antes mencionados, sobre todo, en forma de óxidos, sulfuricos o carbonilos
depositados en soportes de gran superficie.
Los catalizadores homogéneos en muchos casos son activos a la temperatura
ambiente; los heterogéneos precisan temperaturas de reacción de hasta 500ºC.
La metátesis puede servir para aumentar la flexibilidad de los procesos de
obtención de olefinas, como, por ejemplo, aumentar la proporción de etileno de
las mezclas de craqueo de nafta a costa de la del propeno, o como ocurre en los
EE.UU., donde durante mucho tiempo el proceso catalítico de craqueo no ha
producido cantidades suficientes de butadieno y se ha necesitado buteno
adicional para obtener butadieno por deshidrogenación.
La Phillips-Petroleum introdujo el desproporcionamiento en el proceso
Triolefina en los años sesenta. En Canadá la Shawinigan mantenía desde 1966 una instalación industrial
con una capacidad anual de 30 000 toneladas, pero por cuestiones económicas por
variar las condiciones de la materia prima, tuvo que pararla en 1975.
Las condiciones de reacción se diferencian por los catalizadores empleados.
Con catalizadores de molibdato de Co son suficientes las temperaturas de
120-210ºC a 25-30 bars para transformar propileno en un 40%; con WO3/SiO2
se indican como necesarias temperaturas de 450-500ºC
La transformación de propileno a 500ºC alcanza el 42%.
El propileno empleado debe estar libre de acetiledno y diolefinas, que
previamente se pueden eliminar
por hidrogenación selectiva con un catalizador de paladio.
Para procesos de metátesis, la BP desarolló un catalizador de Re que en
forma de Re2O7/AI2O3 es mucho
más activo que los dos anteriormente mencionados y, en principio, ya actúa
a temperatura ambiente.
La metátesis ha encontrado otra aplicación industrial en una instalación de
olefinas de la Shell en los
EE.UU. En ella, desde 1977, por oligomerización de etileno en una planta de
200 000 toneladas al año se obtienen 50 000 toneladas de a-olefinas pares C10-C18
y lineales destinadas al sector de detergentes. Las olefinas inferiores y
superiores se someten a un proceso combinado de isomerización de enlaces dobles
y metátesis. Con lo cual, las olefinas con dobles enlaces interiores que se
forman preferentemente por isomerización, en una segunda etapa por metátesis
con etileno (etenólisis) se transforman en olefinas terminales:
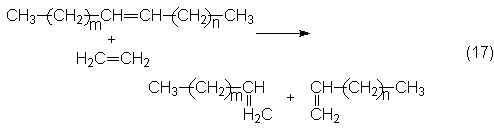
Con esto se consiguen olefinas adicionales en la fracción deseada C11-C14,
que, por ejemplo, por hidroformilación dan origen a alcoholes para detergentes
C12-C15. Las olefinas superiores e inferiores que no se
deseen se pueden reciclar. En total se
alcanza una concentración en n-a-olefinas del 94-97%, con un contenido
en monoolefinas superior al 99,5%. En 1981 se podrá en servicio una instalación
semejante con capacidad anual de 175 000 toneladas.
Aun cuando la reacción de metátesis, desde su descubrimiento a mitad de los
años cincuenta, ha ocupado a muchos grupos de investigación, sólo han
encontrado aplicación industrial las pocas anteriormente citadas. Se puede
contar con un posible futuro desarrollo de la polifacética metátesis y su
empleo intenso en la industria.
Otras aplicaciones posibles podrán ser las que se obtengan por la serie de
reacciones que está investigando la Phillips Petroleum en una instalación
piloto de unas 225 toneladas al año. A
estas corresponde, por ejemplo, la obtención de neohexeno (3,3-dimetil-1-buteno)
como componente de carburante
resistente al picado, que se puede obtener por etenólisis de di-i-buteno
industrial (cerca del 75% de 2,4,4-trimetil-2-penteno) con formación de
i-buteno como coproducto:
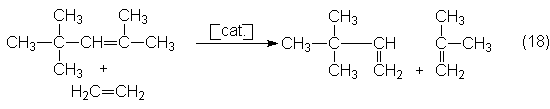
Otro ejemplo de reacción es la obtención de a,w-diolefinas por etenólisis de ciclo-olefinas. Así, el
fácilmente accesible ciclododeca-1,5,9-trieno (ver <<Ciclotrimerización del butadieno>>, apartado 10.1.2) por hidrogenación
selectiva se convierte en ciclododeceno y éste, por metátesis con etileno, da
tetradeca-1,13-dieno:
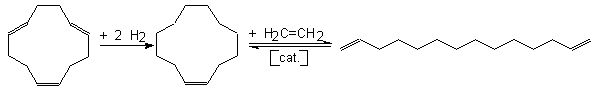
Los a,w-dienos son de interés industrial como reticulantes en la polimerización de
olefinas.
El ciclododeceno puede además, mediante una metátesis de curso paralelo,
ser producto de partida para un polidodecenómeros, reacción que en ausencia de
etileno puede ser reacción principal. Esta comienza con una expansión de ciclos
para dar olefinas cíclicas con doble número de carbonos:
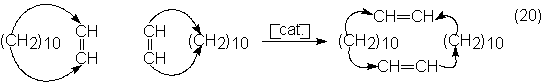
Otro interesante caso industrial de reacción de metátesis es la dismutación
de i-buteno y 2-buteno para obtener un precursor del isopreno (ver apartado
5.2.2).