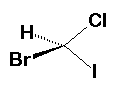Estereoquímica en Química Orgánica
Carlos Rius Alonso
©1998
Facultad de Química
UNAM
Enantiómeros
Los estereoisómeros son
compuestos que tienen la misma fórmula molecular y el mismo tipo de uniones
pero difieren en la forma que estas están distribuidas en el espacio.
Los alquenos presentan
estereoisómeros. Al ser planar la doble ligadura y no tener rotación libre
podemos tener sustituyentes diferentes en el espacio . Estos estereoisómeros se
identifican como E ó Z.
|
|
|
|
|
(E)-But-2-eno |
(Z)-But-2-eno |
ambos |
Una segunda forma de
estereoisomerismo ocurre en compuestos que tienen una estructura tridimensional
y los sustituyentes están acomodados de tal forma que no podemos sobreponerlos
a su imagen en el espejo. Los objetos que presentan esta propiedad se conocen
como compuestos quirales. La naturaleza nos presenta con una gran
variedad de este tipo de objetos como nuestras manos (la derecha es la imagen
en el espejo de la izquierda , y no las podemos sobreponer)
Mostramos dos moléculas quirales con sus imágens en el espejo cada imagen se
puede rotar libremente. Aunque rotemos las moléculas y tratemos de
sobreponerlas En el primer ejemplo los dos isómeros se muestran en un marco
como si un espejo si se hubiera puesto para demostrar el fenómeno.
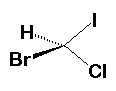
Bromocloroiodometano.
|
Dibujos |
Modelo 3-D |
|
|
|
|
|
|
|
- |
En este caso hay que rotar los
modelos de tal forma que los dos halógenos coincidan en la misma posición,
observe los otros dos sustituyentes y verá que apuntan a direcciones diferentes
por lo que las moléculas no se pueden sobreponer. Para poder convertir un
isómero en el otro necesitamos cuando menos romper un par de uniones y
volverlas a formar en la nueva orientación, o sea se trata de dos compuestos
diferentes que no son inerconvertibles.
Hexaheliceno.
|
|
En este caso la molécula tiene la
forma de la cuerda de un tornillo, por lo que su imagen en el espejo tendrá la
cuerda en la dirección opuesta y no se podrían sobreponer. Nuevamente tenemos
el caso de dos moléculas diferentes..
Enantiómeros.
Cuando una molécula es quiral, la
molécula y su imagen en el espacio se dicen que son enantiómeros. Los
enantiómeros son imagen en el espejo uno de otro y que no se puedan sobreponer.
Detección de la existencia de enantiómeros.
La quiralidad es un fenómeno
debido a la orientación espacial de las moléculas.
Para algunas moléculas como el
hexaheliceno mostado arriba, el reconocer que lo molécula es quiral es más
dificil y se requiere de la estructura tridimensional para observarla.
Sin embargo la detección de la
quiralidad en la mayoría de las moléculas orgánicas es fácil, debido a que el
átomo de carbono se encuentra en forma tetrahedral los grupos se acomodan en el
espacio en el ejemplo del bromocloroiodometano su arregrlo tetrahédrico hace
que exista quiralidad.
. :
Para moléculas orgánica simples, la presencia o no de quiralidad se
puede determinar buscando un átomo de carbono con hibridación sp3 y
que tenga los cuatro átomos o grupos de átomos unidos a el diferentes.
La presencia de uno de estos carbones indica que existe una
molécula quiral. Este átomo de carbono es un estereocentro ó centro
esteregénico.
Un centro estereogénico es un átomo unido a varios otros átomos que
tienen la propiedad de que si se intercambian dos de las uniones da lugar a
diferentes estereoisómeros ( no necesariamente enantiómeros).
Para el caso del carbono como
tiene geometría tetrahedral para sus cuatro sustituyentes, significa que solo
dos estereoisómeros se pueden formar intercambiando un par de átomos.
Si más de un centro estereogénico
está presente no se puede asegurar que la molécula es quiral sin examinarla
como un todo.
Ejemplos de moléculas que son quirales por la presencia
de un centro estereogénico en un carbono:
2-Butanol: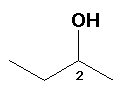
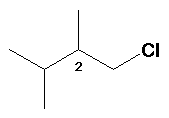
1-Cloro-2,3-dimetilbutano:
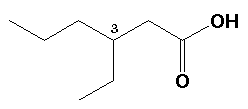
Acido 3-Etilhexanoico
:
Más de un centro estereogénico en una molécula.
Es posible tener varios centros
estereogénicos en una molécula. Para cada una de estos centros existen dos
arreglos espaciales para los cuatro grupos. De esta forma si hay dos centros
las posibilidades son 4 moléculas. Para tres centros el número de posibilidades
es de 8 Se puede observar que el número de isómeros posibles para n
centros estereogénicos es 2n.
Sin embargo cuando hay dos o más
carbonos quirales, existe la posibilidad de simetría en la molécula, como puede
ser un plano de simetría entre los centros. Como consecuencia, es posible tener
una molécula con varios centros estereogénicos pero que no sea quiral. Si
tenemos más de un carbono quiral en una molécula el número calculado de
estereoisómeros, 2n es el máximo posible pero para algunas estructuras
habrá menos isómeros
Antes de continuar con la
nomenclatura de moléculas quirales necesitamos familiarizarnos con varias
representacions de las moléculas
Diagramas de lineas
Proyecciones de Newman
Proyecciones de Fischer
Siguiente página : Nomenclatura R y S