PRACTICA V
PREPARACION DE CICLOHEXENOI. OBJETIVOS
a) Preparar ciclohexeno por deshidratación catalítica de ciclohexanol.
b) Comprender la influencia de factores experimentales que modifican una reacción reversible.
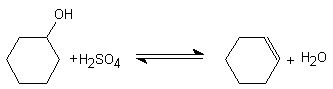
REACCION

II. MATERIAL
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
2 |
|
1 |
|
1 |
|
1 |
|
1 |
|
3 |
|
1 |
|
1 |
|
1 |
|
2 |
|
2 |
|
1 |
|
1 |
|
1 |
III. SUSTANCIAS
|
10.0 ml |
|
5.0 ml |
|
0.5 ml |
|
25 ml |
|
15 ml |
|
1 ml |
|
2.0 g |
|
2.0 g |
IV. INFORMACION
a) La reacción para obtener ciclohexeno a partir de ciclohexanol es reversible.
b) La reversibilidad de una reacción se puede evitar; si se elimina el producto del medio de reacción a medida que ésta sucede; si se aumenta la concentración de uno o varios de los reactivos; si se aumenta o diminuye la temperatura en el sentido que se favorezca la reacción directa, etc.
c) Por lo tanto, las condiciones experimentales en las que se efectúa una reacción determinan los resultados de ésta en cuanto a calidad y cantidad del producto.
V. PROCEDIMIENTO
Preparar el ciclohexeno a partir de ciclohexanol por dos procedimientos diferentes (Método A y Método B) y comparar los resultados obtenidos en cuanto a calidad y cantidad del producto, a fin de conocer que método es más eficiente.
Luego se comprobará a través de reacciónes específicas de identificación, la presencia de dobles ligaduras en el ciclohexeno obtenido (pruebas de insaturación).
Método A
. Por destilación fraccionada.Monte un equipo de destilación fraccionada (Nota 1). En el matraz pera de una boca coloque 10 ml de ciclohexanol, agregue gota a gota y agitando 0.5 ml de ácido sulfúrico concentrado, agregue cuerpos de ebullición y adapte el resto del equipo. Posteriormente vierta en la trampa 25 ml de la solución de permanganato de potasio.
Emplee un baño de aire y caliente moderadamente el vaso de pp con el mechero, a través de la tela de asbesto. Reciba el destilado en el matraz de bola y enfrie todo lo que destile entre 80-85oC en un baño de hielo.
Suspenda el calentamiento cuando solo quede un pequeño residuo en el matraz o bien empiecen a aparecer vapores blancos de SO2.( Nota 2)
Sature el destilado con cloruro de sodio y decántelo en el embudo de separación, lavelo 3 veces con una solución de bicarbonato de sodio al 5% empleando porciones de 5 ml cada vez.
Reciba luego, la fase orgánica en un vaso de precipitados y séquela con sulfato de sodio anhídro. Esta fase orgánica debe ser ciclohexeno, el cual deberá purificar por destilación simple, empleando un baño de aire (Nota 3). Colecte la fracción que destila a la temperatura de ebullición del ciclohexeno (Nota 4).
La cabeza y la cola de la destilación pueden utilizarse para hacer las pruebas de insatura- ción, que se indican al final de este procedimiento.
Mida el volúmen obtenido y entréguelo al profesor. Calcule el rendimiento de la reacción.
Método B.
Por reflujo directo.La realización de este método tiene por objetivo establecer una comparación con el anterior en cuanto a los resultados que se obtengan. Por esta razón, sólo un alumno pondrá en práctica este método en tanto los demás deberán tomar en cuenta el resultado para hacer la comparación respectiva.
Monte un equipo de reflujo directo. En el matraz pera de una boca coloque 10 ml de ciclohexanol, agreque gota a gota y agitando 0.5 ml de ácido sulfúrico concentrado, agregue cuerpos de ebullición y adapte el resto del equipo.
Caliente el sistema con el mechero a través de la tela de alambre, empleando un baño de aire, durante 45 minutos.
Luego déjelo enfriar un poco y vierta la mezcla de reacción en una suspensión de 2 g de bicarbonato de sodio en 10 ml de agua. Separe entonces la fase orgánica, lávela con 3 porciones de 5 ml de solución saturada de bicarbonato de sodio y séquela con sulfato de sodio anhídro. Purifique por destilación simple, empleando un baño de aire, el ciclohexeno obtenido.
Mida el volúmen obtenido y entréguelo al profesor. Calcule el rendimiento de la reacción.
Realice las siguientes pruebas de insaturación
.1) Reacción con Br2/CCl4
En un tubo de ensaye coloque 1 ml de solución de bromo en tetracloruro de carbono, agregue 1 ml de ciclohexeno y agite. Observe e interprete los resultados. Escriba la reacción que se lleva a cabo.
2) Reacción con KMnO4En un tubo de ensaye coloque 1 ml de solución de permanganato de potasio (acidulada a pH 2 ó 3), agregue 1 ml de ciclohexeno y agite. Observe e interprete los resultados. Escriba la reacción que se lleva a cabo.
Resuma en el siguiente cuadro los datos experimentales de los dos métodos de obtención del ciclohexeno.
|
Métodos |
Condiciones Experimentales |
Temperatura de la destilación |
Volumen del destilado (ml) |
% de la reacción |
|
A |
||||
|
B |
NOTAS
1) Para aumentar el gradiente de temperatura en la columna cúbrala exteriormente con fibra de vidrio.
2) Enfrie muy bien el aparato antes de desmontar y coloque el matraz de bola con su tapón en un baño de hielo.
3) Tenga cuidado de utilizar el material bien limpio y seco.
4) El punto de ebullición del ciclohexeno es de 83-84o C. a 760 mm Hg y la presión atmosférica en la Ciudad Universitaria D.F. es de 585 mmHg, por lo que destila a 71-74oC.
VI. ANTECEDENTES
a) Propiedades físicas, químicas y toxicidad de reactivos y productos.
b) Deshidratación catalítica de alcoholes para obtener alquenos. Mecanismo de reacción.
c) Influencia de las condiciones experimentales en la reversibilidad de una reacción.
d) Reacciones de adición a dobles ligaduras.
VII. CUESTIONARIO
1.- Con base en los resultados obtenidos, ¿cuál de los dos métodos es el más eficiente para obtener ciclohexeno? Explique.
2.- a) ¿Qué es una reacción reversible?
b) ¿Qué es una reacción irreversible?
c) ¿Qué es una reacción en equilibrio?
3.- ¿Cuáles fueron los principales factores experimentales que se controlaron en esta práctica?
4.- ¿Qué debe hacer con los residuos de la reacción depositados en la pera o matraz antes de desecharlos por el drenaje?
5.- ¿Cuál es la toxicidad de los productos que se forman al realizar las pruebas de insaturación ?
6.- Asigne las bandas principales a los grupos funcionales presentes en los espectros de I.R. de reactivos y productos.
Espectros de I.R.
a) Ciclohexanol
VIII. BIBLIOGRAFIA
a) Brewster R.Q., Vander Werf C.A. y Mc. Ewen W.E.
Curso Práctico de Química Orgánica,
2a. Edición
Alhambra
Madrid,1979.
b) Vogel A.I.
A textbook of Practical Organic Chemistry.
Fourth Edition
Longmans
London, 1978.
c) Pavia D.L.,Lampman G.M. y Kriz G.S.
Introduction to Organic Laboratory Techniques.
W.B. Saunders Co.
Philadelphia, 1976