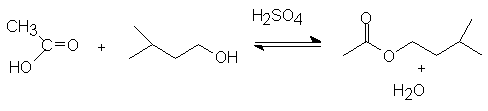
PRACTICA X-A
OBTENCION DE ACETATO DE ISOAMILO
(ACEITE DE PLATANO)
I. OBJETIVO
a) Preparar un éster a partir de un alcohol y un ácido carboxílico.
b) Aplicar algunas técnicas de laboratorio ya conocidas como son calentamiento a reflujo, extracción y destilación simple.
REACCION
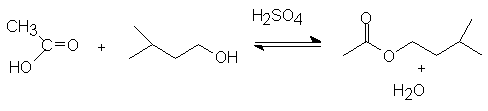
II. MATERIAL
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
2 1 |
|
1 |
III. SUSTANCIAS
|
4.5 ml |
|
22.5 ml |
|
6 ml |
|
2.5 g |
|
1 ml |
|
1 g |
IV. INFORMACION
La reacción de un ácido carboxílico con un alcohol en presencia de un catalizador ácido es uno de los métodos habituales de preparación de ésteres.
Tanto la esterificación como la reacción inversa, la hidrólisis de ésteres, han sido muy estudiadas con el fin de elucidar el mecanismo de este proceso reversible.
V. PROCEDIMIENTO
Coloque en un matraz pera de una boca 4.5 ml de alcohol isoamílico, 6 ml de ácido acético glacial y añada agitando cuidadosamente 1 ml de ácido sulfúrico conc. (Nota 1), agregue núcleos porosos para regular la ebullición y conecte el condensador en posición de reflujo.
Caliente la mezcla de reacción en baño de aire manteniendo el reflujo durante una hora. Pasado este tiempo suspenda el calentamiento, retire el baño de aire y enfrie la mezcla de reacción a temperatura ambiente.
Pase la mezcla fría a un embudo de separación y agregue cuidadosamente 14 ml de agua fría, lave el matraz de reacción con 2.5 ml de agua y pase al embudo de separación. Agite varias veces, separe la fase acuosa y deséchela, la fase orgánica contiene el éster y un poco de ácido acético, el cual puede ser removido por dos lavados sucesivos con 7.5 ml de una solución de bicarbonato de sódio al 5% (Nota 2). Lave la capa orgánica con 6 ml de agua mezclados con 1.5 ml de una solución saturada de cloruro de sodio. Deseche la capa acuosa, vierta la fase orgánica en un vaso de precipitados y seque con un gramo de sulfato de sodio anhidro (Nota 3).
Monte un aparato de destilación simple (Nota 4), decante la fase orgánica al matraz pera, agregue núcleos porosos para regular la ebullición y destile.
El recipiente que reciba el destilado deberá estar en un baño de hielo. Colecte la fracción que destila entre 132-134o C y calcule rendimiento
NOTAS
1) Hágalo cuidadosamente y con agitación constante.
2) !PRECAUCION! Se produce CO2. Este procedimiento se repite hasta que la capa orgánica esté alcalina. Verifique pH.
3) Se necesitan casi 15 minutos para que el secado sea completo, si después de este tiempo la solución sigue turbia, decante la solución y añada otro gramo de agente desecante.
4) El material debe de estar limpio y seco.
VI. ANTECEDENTES
1.- Métodos de obtención de ésteres.
2.- Propiedades físicas químicas y toxicidad de reactivos y productos.
VII. CUESTIONARIO
1.- Escriba un mecanismo razonable para la formación del acetato de isoamílo.
2.- Un método para favorecer la formación del éster, es añadir un exceso de ácido acético. Sugiera otro método que permita desplazar la reacción hacia la formación del éster.
3.- Haga un esquema de la separación del acetato de isoamílo de la mezcla de reacción.
4.- Explique cuáles son los usos de los ésteres.
5.-Asigne las bandas principales a los grupos funcionales presentes en los espectros de I.R. de reactivos y productos.
Espectros de I.R.
b) Acetato de isoamiloa) D. Pavia, G.M. Lampman y G.S. Kriz Jr.
Introduction to Organic Laboratory Techniques.
W.S. Saunders Co.
Philadelphia U.S.A. (1976)
pag 94.
b) Solomons T.W.G.
Química Orgánica
Edit. Limusa (1979)
pag. 608.
c) Streitwieser A.,Heathcok H.C.
Química Orgánica
Edit. Interamericana (1979)
pag 451.
d) R.T. Morrison y R.N. Boyd
Química Orgánica
2ª Edición
Fondo Educativo Interamericano (1985)
Diagrama de flujo de tratamiento de residuos