Página principal http://organica1.org
24 SN2 contra SN1
Hasta el momento hemos descrito dos mecanismos para la sustitución
nucleófilica: el SN2, caracterizado por
(a)
una cinética de segundo
orden,
(b)
inversión estereoquímica
completa,
(c)
ausencia de
transposiciones, y
(d)
la secuencia de
reactividades CH3W >1º
> 2º > 3º;
y el SN1, caracterizado por
(a)
una cinética de primer
orden,
(b)
racemización,
(c)
transposiciones, y
(d)
la secuencia de
reactividades 3º> 2º> 1º > CH3W.
Excepto la mención breve de la sección haluros12,
hemos tratado estos mecanismos como temas separados. Estudiemos ahora la
relación entre ambos. Para un sustrato dado y un determinado conjunto de
condiciones, ¿cuál será el emcanismo que seguirá una reacción?, ¿qué podemos
hacer, en todo caso, para dirigirla hacia uno u otro mecanismo?
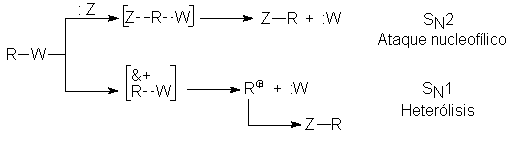
Para responder a estas preguntas, consideremos lo que sucede a una
molécula del sustrato. Puede sufrir un ataque por atrás por el nucleófilo, o
bien someterse a una heterólisis, con formación de un carbocatión. El proceso
que sea más rápido será el que determine el mecanismo predominante. (Recuérdese: heterólisis es el primer
paso del mecanismo SN1 y determinante de la velocidad.) Una vez más,
debemos prestar atención a la velocidad
relativa de las reacciones que compiten.
Examinemos cada uno de los componentes del sistema de reacción y
veamos el efecto que ejerce sobre esta competencia entre el ataque nucleofílico
y la heterólisis.
Comencemos con el sustrato,
que consta de dos partes: el grupo alquilo y el grupo saliente. La naturaleza del grupo saliente es, por
cierto, vital para que ocurra sustitución.
Cualquiera que sea el proceso que se está realizando, ataque nucleofílico
o heterólisis, se está rompiendo la unión con el grupo saliente; cuanto más
fácil resulte esta ruptura esto es, cuanto mejor sea el grupo saliente, mas
rápidamente procede la reacción. Un grupo saliente mejor acelera, por tanto, la
reacción de ambos mecanismos, y, efectivamente, acelera ambos aproximadamente
en igual magnitud. El resultado es que la naturaleza del grupo saliente tiene
poco efecto sobre el predominio de uno u otro mecanismo.
En contraposición, la naturaleza
del grupo alquilo, R, del sustrato ejerce un efecto profundo en el
mecanismo que se seguirá. En R operan dos factores: el impedimento estérico,
que determina en gran medida la facilidad del ataque por atrás; y la capacidad
para acomodar una carga positiva,
que determina preponderantemente la facilidad de la heterólisis. Procediendo en
las serie de alquilos simples CH3, 1º, 2º, 3º, el grupo R resulta
por definición, más ramificado. Hay un aumento regular en el número de
sustituyentes sobre el carbono: sustituyentes voluminosos, liberadores de
electrones. Aumenta el impedimento estérico, con lo que el ataque por atrás se
hace más difícil y, por consiguiente, más lento. Al mismo tiempo aumenta la
capacidad para acomodar una carga positiva: la heterólisis se hace más fácil y
rápida.
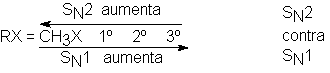
El resultado es el esquema que ya hemos visto: para sustratos
metílicos y primarios, una predisposición hacia SN2; para
terciarios, una predisposición hacia SN1. Para los sustratos
secundarios, hay una tendencia hacia un comportamiento intermediario: una
mezcla de ambos mecanismos o, como veremos en la sección siguiente, quizás un
mecanismo con características tanto de SN2 como de SN1.
A pesar de esta predisposición de un sustrato en particular hacia uno
u otro mecanismo, podemos controlar el curso de una reacción en un grado
considerable mediante nuestra selección de condiciones experimentales. Para
apreciar cómo puede lograrse esto, examinaremos los demás componentes del
sistema reaccionante.
Analicemos ahora el nucleófilo.
La diferencia clave entre los mecanismos SN2 y SN1 reside
realmente en cuándo participa el nucleófilo: en el paso que determina la
velocidad del SN2, pero después del paso determinante de la
velocidad de SN1. Esta
diferencia en la secuencia conduce directamente a dos factores que contribuyen
a precisar el mecanismo que ha de seguirse: la concentración del nucleófilo y su naturaleza.
La velocidad de SN2 depende de la concentración del
nucleófilo, [:Z] ; sabemos que la reacción es de segundo orden (haluros13).
![]()
La velocidad de SN1 es independiente de [:Z] ; la reacción
es de primer orden (haluros16).
![]()
Un aumento en [:Z] acelera la reacción de segundo orden, pero no tiene
ningún efecto sobre la de primer orden: la fracción de la reacción por SN2
aumenta. Una disminución de [:Z] retarda la reacción de segundo orden, pero no
ejerce efecto sobre la de primer orden: disminuye la fracción de la reacción
por SN2. El resultado neto es que, a igualdad de otras condiciones, una concentración elevada del nucleófilo
favorece la reacción SN2, y una concentración baja favorece la
reacción SN1.
La velocidad de SN2 depende, igualmente, de la naturaleza del
nucleófilo: uno más fuerte ataca más velozmente al sustrato. La velocidad de SN1
es independiente de la naturaleza del
nucleófilo: más fuerte o más débil, el nucleófilo espera hasta que se
haya formado el carbocatión. El resultado neto es que, a igualdad de otras
cosas, un nucleófilo fuerte favorece la reacción SN2, y un
nucleófilo débil favorece la reacción SN1.
Ya tuvimos ocasión de apreciar
este efecto en la sección haluros23. El bromuro de
neopentilo reacciona con el nucleófilo fuerte, etóxido, para generar neopentil
etil éter no transpuesto, lo que claramente es una reacción SN2.
Reacciona con el nucleófilo débil, etanol, para dar t-pentil etil éter
transpuesto: es, sin lugar a dudas, una reacción SN1.
No hemos considerado el tercer componente del sistema, el que ofrece
el mayor campo de acción para el control de una reacción: el disolvente. En el capítulo 6
examinaremos detalladamente su papel.
Al comenzar este capítulo dijimos que una reacción química es el
resultado de una competencia: lo que
realmente sucede cuando se mezcla un conjunto de reactivos en ciertas
condiciones particulares es aquello que ocurre más rápido. Hasta ahora nos ha interesado la competencia que hay
entre dos caminos diferentes para la sustitución nucleofílica. En el capítulo 7
encontramos una competencia adicional: entre la sustitución nucleofílica y un
tipo de reacción totalmente diferente: la eliminación. En todo esto, lo que nos
interesa son los factores que favorecen un mecanismo o un tipo de reacción
sobre otra y Un, cuando es posible, lo que podemos hacer para controlar el
resultado.