Página principal http://organica1.org
23 Transposición de
carbocationes
Anteriormente dijimos que el desarrollo de la teoría de los
carbocationes se debe a un esquema de comportamiento. La característica más
destacada de ese esquema es la ocurrencia de transposiciones.
Por ejemplo, en la sustitución nucleofílica se observa a veces que el
grupo entrante, Z, se une a un carbono distinto al que originalmente estaba
ligado el grupo saliente, X. Por ejemplo:
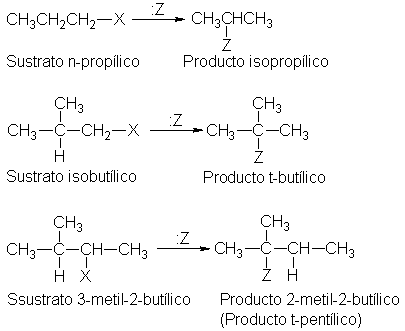 Ejemplo:
Ejemplo:
En cada uno de estos casos podemos observar que, para acomodar Z en la
posición nueva, debe producirse una transposición de átomos de hidrógeno en el
sustrato. La transformación de un grupo n-propilo a uno isopropílico, por
ejemplo, requiere la eliminación de un H del C-2, y la unión de un H al C-1.
Aveces, se produce incluso una transposición del esqueleto carbonado.
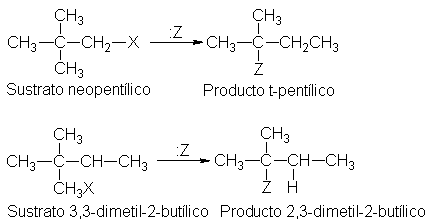
En reacciones de tipos diferentes eliminación, adición, también se
observan transposiciones similares a las presentadas. Esta similitud de
comportamiento plantea una similitud en el mecanismo. Por muy distintos que
sean los diversos mecanismos, todos tienen una característica común: en alguna
etapa se forma el mismo intermediario, y es éste el que sufre la transposición.
Este intermediario, propuesto claramente por primera vez en 1922 por Hans
Meerwein (Sec. 5.17), es el carbocatión.
Pues bien, de los dos mecanismos propuestos para la sustitución
nucleofílica, solamente el SN1 se postula que involucra un
carbocatión intermediario, por lo que solo esperamos que las reacicones
procedentes de SN1 se acompañen por estas transposiciones
características. En contraste, el paso único postulado para SN2,
sencillamente no proporciona oportunidades para tales transposiciones.
La suposición anterior se corrobora experimentalmente, como se ilustra
en el siguiente ejemplo. Los sustratos de neopentilo son particularmente
propensos a transponerse a productos t-pentílicos: en una solución de etóxido
de sodio en etanol, el bromuro de neopentilo sufre una reacción (lenta) de segundo orden, generado éter etil
neopentil, no transpuesto; en una solución que sólo contiene etanol, sufre una
reacción (lenta) con cinética de primer orden, para dar éter etil t-pentil (y
otros productos transpuestos).

La ocurrencia y ausencia de una transposición es una diferencia
notable, y proporciona otra pieza de evidencia de que hay dos mecanismos para la sustitución nucleofílica. Además, la
transposición es un apoyo poderoso para la forma particular del mecanismo SN1
la mediación de carbocationes, porque liga este mecanismo a otros de aquellas
clases de reacciones en las que también se observan transposiciones. La
correlación entre transposición y cationes intermediarios es tan fuerte que, en
ausencia de otra información acerca de un ejemplo particular de sustitución
nucleofílica, se considera una transposición como evidencia de que la reacción
es SN1.
Sobre esta base, entonces, podemos explicar los productos observados
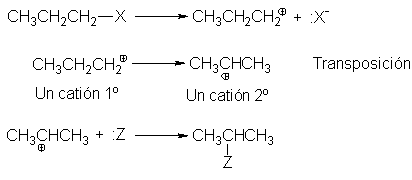
de la manera siguiente. Un sustrato n-propílico, por ejemplo, da el catión
n-propilo, el cual se transpone el catión isopropilo, que se combina con el
nucleófilo para dar el producto de isopropilo.
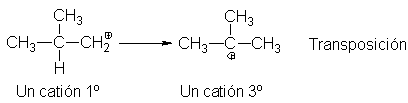
De manera similar, el catión isobutilo se transpone al t-butilo,
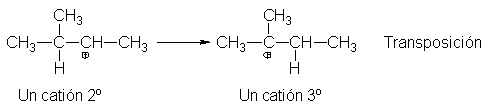
El catión 3-metil-2-butil se transpone al 2-metil-2-butilo,
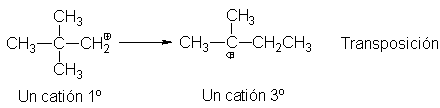
El catión neopentilo se transpone al t-pentilo,
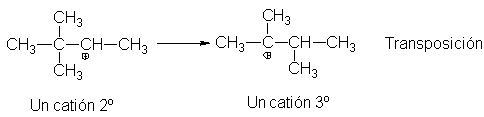
Y el catión 3,3-dimetil-2-butilo se transpone al 2,3-dimetil-2-butilo.
Podemos observar en cada caso,
que la transposición se realiza de manera tal que un catión menos estable se
convierte en otro más estable: uno primario en uno secundario, uno primario
en uno terciario, o uno secundario en uno terciario.
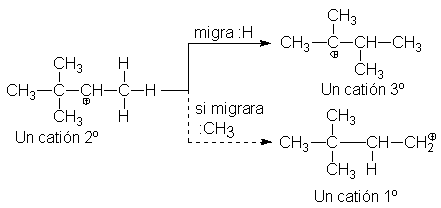
¿Cómo sucede esta transposición? Frank Whitmore (Universidad del
Estado de Pensilvania)describió la transposición así: un átomo de hidrógeno o
un grupo alquilo migra con un par de
electrones desde un carbono que pierde al grupo migratorio adquiere la
carga positiva. Una migración de hidrógeno con un par de electrones se conoce
como desplazamiento de hidruro; una
migración similar de un grupo alquilo es un
desplazamiento de alquilo. Estos son sólo dos ejemplos del tipo más común
de transposición, los desplazamientos
1,2: las transposiciones en las que el grupo que migra se desplaza de un
átomo al vecino inmediatamente.

Podemos explicar las transposiciones en reacciones SN1 como
sigue. Se forma un carbocatión por pérdida del grupo saliente del sustrato. Si un desplazamiento 1,2 de hidrógeno o
alquilo puede generar un carbocatión más estable, entonces tiene lugar esa
transposición. El carbocatión nuevo se combina ahora con el nucleófilo,
para dar el producto de la sustitución.
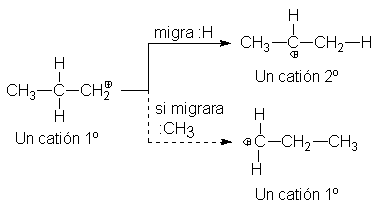
En el caso del catión n-propilo, por ejemplo, un desplazamiento de
hidrógeno da el más estable catión isopropilo; la migración de un metilo sólo
formaría un catión n-propilo diferente.
 En el catión isobutilo, el desplazamiento de hidruro da un catión terciario,
por lo que se prefiere a una migración de metilo, que sólo generaría un catión
secundario.
En el catión isobutilo, el desplazamiento de hidruro da un catión terciario,
por lo que se prefiere a una migración de metilo, que sólo generaría un catión
secundario.
En el caso del catión 3,3-dimetil-2-butilo, por otra parte, un
desplazamiento de metilo puede dar un catión terciario, y es la transposición que
tiene lugar.
Podemos imaginar la transposición como una reacción ácido-base
intramolecular, en la que el ácido más fuertecomo es usual, toma la base. La
base es el grupo migratorio con sus electrones (hidruro o alquilo). Compiten
por ella dos ácidos de Lewis: lso carbonos electrónicamente deficientes en los
carbocationes alternativos. En la transposición n-isopropilo, por ejemplo, es
más deficiente en electrones el C-1 y, por consiguiente, es el ácido más
fuerte, por lo que termina tomando la base.
Al igual que se comprobó la realidad de los carbocationes, también se
comprobó la de su transposición. Preparados en condiciones superácidas del
método de Olah, y estudiados mediante la espectroscopia, ha podido observarse la transposición de carbocationes; ha podido
medirse la velocidad de algunas transposiciones y se han calculado sus Eact.
Si se añade agua, ésta se combina con el catión transpuesto, apareciendo el OH
en una nueva posición en la molécula. Nuevamente observamos aquí los pasos
propuestos para SN1 como etapas individuales, pero esta vez con
transposición: primero, la formación de un carbocatión; después, su
transposición a un nuevo catión, y, finalmente, la combinación de este catión
transpuesto con el nucleófilo.
En nuestra breve familiaridad con el carbocatión, hemos conocido dos
de sus reacciones. Un carbocatión puede:
(a)
combinarse con un
nucleófilo;
(b)
transponerse a un
carbocatión más estable.
Esta lista crecerá rápidamente.
En una transposición, como en todas las demás reacciones de un
carbocatión, el átomo de carbono deficiente en electrones gana un par de éstos,
a expensas ahora de un átomo de carbono vecino, uno capaz de acomodar mejor la
carga positiva.
En el capítulo 6 veremos otro aspecto de la reacción SN1 y
examinaremos el factor que hace posible todo: el disolvente. Por ahora,
regresemos al punto inicial, la competencia entre SN1 y SN2.