Página principal http://organica1.org
22 Reacción SN1: reactividad.
Facilidad de formación de
carbocationes
Volvamos una vez más a la sustitución nucleofílica y a la pregunta de
cómo la estructura del grupo alquilo afecta a la reactividad. Ya vimos (haluros15) que la reactividad SN2 disminuye en
la serie CH3W, 1º, 2º, 3º, como postularon Hughes e Ingold (haluros12). Veamos ahora cuáles son los hechos en
relación con la otra mitad de su teoría dual: ¿cambia la reactividad por SN1
en el sentido contrario a lo largo de la misma serie?
En condiciones que favorezcan ampliamente la SN1, se
obtienen los resultados siguientes:
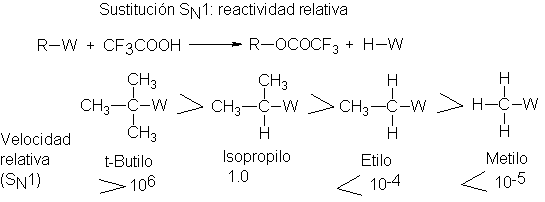
Se confirma así el orden de reactividades postulado. También, las
diferencias en reactividad son, como se señaló, mucho más grandes que las que
se encontraron para la reacción SN2 véase la curva SN1
fuertemente ascendente de la figura 5.1 (haluros12).
Pos SN1, los sustratos terciarios son más de un millón de veces más
reactivos que los secundarios, que a su vez son por lo menos 10 000 veces y es
probable que más de un millón más reactivos que los primarios.
Incluso se cree que estas diferencias están subestimadas. Las
reactividades de los sustratos primarios y metílicos son muy inferiores a los
valores máximos indicados; es probable que aun las bajas velocidades medidas
para ellos son en gran parte SN2, no para SN1, actuando
el disolvente como nucleófilo.
![]() En consecuencia, la reactividad de los sustratos en la reacción SN1
sigue la secuencia:
En consecuencia, la reactividad de los sustratos en la reacción SN1
sigue la secuencia:
Ahora bien, el paso determinante de la velocidad en SN1 es la formación del
carbocatión; esto es, un sustrato sufre SN1 más rápido que otro
porque forma el carbocatión más rápido.
Por tanto, nuestra secuencia de reactividad conduce directamente a otra que indica la velocidad relativa de formación de carbocationes:
![]()
Al ordenar los carbocationes de acuerdo con su velocidad de formación,
lo hemos hecho simultáneamente en el orden de sus estabilidades. Cuanto más estable es un carbocatión, más
rápida es su formación.
Probablemente ésta es la generalización más conveniente de la
estructura y reactividad que aparece en este libro o que de hecho existe en la
química orgánica. Los carbocationes se generan a partir de muchos compuestos
distintos de los halogenuros de alquilo, y en reacciones diferentes de la
sustitución nucleofílica. No obstante, en
todas estas reacciones, en las que se generan carbocationes, la estabilidad de
éstos desempeña un papel importante en
el gobierno de la reactividad y la orientación.
¿Cómo podemos demostrar el hecho de que la velocidad de formación de
un carbocatión depende de su estabilidad? Como siempre, para dar respuesta a
esto, debemos considerar la reacción específica implicada en este caso, la SN1
y comparar la estructura de los reactivos con la del estado de transición.
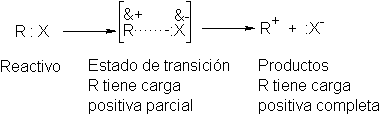
En una reacción SN1 de un halogenuro de alquilo, el
carbocatión se forma por heterólisis de la molécula del sustrato; esto es, por
ruptura del enlace carbono-halógeno. En el reactivo, el carbono y el halógeno
comparten un par de electrones; salvo por una polaridad moderada, estos dos
átomos son neutros. En los productos, el halógeno se ha llevado consigo el par
de electrones, quedando el carbono con sólo un sexteto: el halógeno es portador
de una carga negativa completa, mientras que el carbocatión tiene una carga
positiva neta centrada en un carbono.
En el estado de transición, el enlace C-X debe estar parcialmente
roto, y el halógeno ya ha quitado parcialmente el par de electrones al carbono.
Aquél ha ganado parcialmente la carga negativa que ha de llevar en el ión
halogenuro. Es más, el carbono ha ganado
parcialmente la carga positiva que ha de llevar en el carbocatión.
Los grupos liberadores de electrones tienden a dispersar la carga
positiva parcial (&+) que se está desarrollando sobre el
carbono, estabilizando así el estado de transición. La estabilización de éste
rebaja la Eact y permite una reacción más rápida (véase Fig. 5.10).
De esta manera, y según el grado de ruptura del enlace C-X, el grupo
alquilo posee el carácter del carbocatión que ha de originar. El mismo factor,
la liberación de electrones, que estabiliza al carbocatión, también estabiliza
al carbocatión incipiente en el
estado de transición.
En 1979, Edward Arnett (Universidad de Duke) y Paul Schleyer
(Universidad de Erlangen-Nurnberg)
publicaron <<una corroboración extraordinaria de la validez fundamental
de la “teoría carbocatiónica de la química orgánica”>>. Para un conjunto
de sustratos de estructuras ampliamente diferentes, compararon los valores de
las Eact de reacciones SN1 con los calores de ionización
en soluciones de superácidos, y hallaron una dependencia cuantitativa directa entre la velocidad de formación de
carbocationes y la estabilidad de éstos.
Confirmaron que el carbocatión más estable se forma más velozmente.
A medida que nos enfrentamos a otras reacciones con formación de
carbocationes, debemos examinar para cada una de ellas la estructura del estado
de transición. En la mayoría de estas reacciones, sino en todas, descubriremos
que el estado se distingue de los reactivos principalmente por parecer al
producto. El carácter carbocatiónico del
estado de transición será el factor que más afecta a la Eact; por
consiguiente, cuanto más estable es el carbocatión, más estable será el estado
de transición que conduce aquel, y más rápido se formará el carbocatión.
Sin embargo, lo estudiado aquí será aplicado de un modo aún más
general. Retornaremos una y otra vez a la relación entre efectos polares y
dispersión de carga, y entre esta última y estabilidad. Hallaremos que estas
relaciones no sólo nos ayudarán a comprender reacciones carbocatiónicas de muchos tipos, sino también todas aquellas
en las que se desarrolla o desaparece una carga bien positiva o negativa. Estas
incluirán reacciones aparentemente tan distintas de la sustitución SN1
como la deshidratación de alcoholes, la adición a alquenos y la sustitución
aromática tanto electrofílica como nucleofílica y las propiedades fundamentales
de acidez y basicidad.
Por consiguiente, las diferencias en la reactividad por SN1
dependen de las diferencias de
estabilidad entre las diversas clases de carbocationes. En la siguiente sección
veremos que estas diferencias de estabilidad llevan a un comportamiento
sorprendente de los carbocationes.