Página principal http://organica1.org
21 Estabilización de carbocationes. Acomodación de
la carga.
Efectos polares
El rasgo característico de un carbocatión es, por definición, su
carbono deficiente en electrones y su correspondiente carga positiva. La estabilidad
relativa de un carbocatión está determinada principalmente por su mayor o menor
capacidad para acomodar dicha carga.
De acuerdo con las leyes de la electrostática, la estabilidad de un sistema cargado aumenta con la dispersión de la
carga. En consecuencia, todo factor que tiende a esparcir la carga positiva
del carbono deficiente en electrones, y distribuirla sobre el resto del ión,
debe estabilizar al carbocatión.
Consideremos un sustituyente, G, ligado a un carbono electrónicamente
deficiente, en lugar de un átomo de hidrógeno. En comparación con este último,
G puede liberar, o aceptar, electrones. Tal
efecto sobre la disponibilidad de electrones en el centro reactivo se denomina efecto polar.

Un sustituyente que libera electrones
tiende a reducir la carga positiva en el carbono deficiente en
electrones; al hacer esto, el propio sustituyente se torna algo positivo: la dispersión de la carga
estabiliza al carbocatión.
Un sustituyente que atrae electrones tiende a intensificar la carga
positiva en el carbono deficiente en electrones, así el carbocatión resulta
menos estable.Acabamos de ver que el orden de estabilidad de carbocationes es
el siguiente:
![]()
Por definición, la distinción entre cationes primero, secundario y
terciario es el número de grupos alquilo ligados al carbono con deficiencia
electrónica. Luego, los hechos establecen
que, cuanto mayor es el número de
grupos alquilo, más estable es el carbocatión.
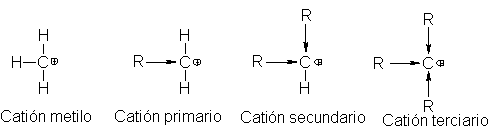
Si nuestra generalización sobre dispersión de carga tiene aplicación
en este caso, quiere decir que los grupos alquilo liberan electrones.
¿Es la liberación de electrones lo que hubiéramos esperado de grupos
alquilo? Ingold (Sec. 5.12) ha propuesto que los grupos alquilo, al carecer de
tendencia polares fuertes propias, pueden realizar prácticamente todo lo que
otros grupos presentes en la molécula les demande. La acumulación de hechos
prueba que efectivamente es así: a menudo, los grupos alquilo tienden a
estabilizar tanto a cationes, como a aniones, indicando liberación o atracción
de electrones según sea la demanda.
En un carbocatión, el carbono con deficiencia electrónica necesita urgentemente
electrones es como si fuera un elemento distinto muy electronegativo, por lo
que induce a los grupos alquilo a
liberarlos para satisfacer esa necesidad.
Ahora,¿cómo ejerce un sustituyente su efecto polar? A pesar de la
cantidad ingente de trabajo realizado y que sigue realizando , no hay acuerdo
general, excepto en que deben operar por lo menos dos factores. Consideremos
que la atracción o liberación de electrones es el resultado de la operación de
dos factores: el efecto inductivo y el de
resonancia:
El efecto inductivo depende de la tendencia <<intrínseca>> de un sustituyente
a liberar o atraer electrones por definición, su electronegatividad, y actúa a
lo largo de la cadena molecular o a través del espacio. El efecto se debilita
gradualmente con el aumento de la distancia al sustituyente. La mayoría de los elementos que suelen sustituir
hidrógeno en una molécula orgánica son más electronegativos que el hidrógeno,
de modo que estos sustituyentes suelen
ejercer efectos inductivos de atracción de electrones: por ejemplo: -F, -CI,
-Br, -I, -OH, -NH2, -NO2.
El efecto de resonancia
implica deslocalización de electrones
típicamente los denominados electrones (pi)-. Depende del solapamiento de
ciertos orbitales, por lo que sólo puede operar cuando el sustituyente se
encuentra localizado de ciertos modos especiales en relación con el centro de
carga. Por su naturaleza, el efecto de resonancia es estabilizante (Sec.
10.14), de modo que supone una extracción de electrones de un centro cargado
negativamente y a una liberación de electrones hacia un centro con carga
positiva.
La naturaleza de la liberación de electrones por los grupos alquilo no
está clara. Puede que se trate de un efecto inductivo; puede ser uno de
resonancia (hiperconjugación, Sección
10.16), siendo proporcionados los electrones por solapamiento de enlaces o con
el orbital p vacío de un carbono deficiente en electrones. Puede muy bien ser
una combinación de ambos. Cuando nos referimos en este texto al efecto
inductivo de grupos alquilo, debe entenderse que éste puede incluir una
contribución de la hiperconjugación.
Como quiera que se genere, el efecto polar de los grupos alquilo no es
poderoso, sin embargo da como resultado diferencias muy grandes de estabilidad
entre las diversas clases de carbocationes. Estas diferencias debemos tenerlas muy
presentes al ocuparnos de la química de los carbocationes, que es muy variada.