Página principal http://organica1.org
20
Estabilidades relativas de carbocationes
Cuando quisimos comparar estabilidades de radicales libres, utilizamos
las energías de disociación homólitica de enlaces, puesto que éstas son las que intervienen en reacciones con generación
de radicales libres.
Queremos comparar ahora estabilidades de carbocationes, y para hacerlo
seguiremos la misma línea de razonamiento que para los radicales libres. Esta
vez, sin embargo, debemos partir de las energías de disociación heterolítica de enlaces, puesto que
éstas se aplican a reacciones con generación de carbocationes. En esta tabla se
registran energías para enlaces que unen bromo con varios grupos. Estos valores
son los H de las reacciones siguientes:
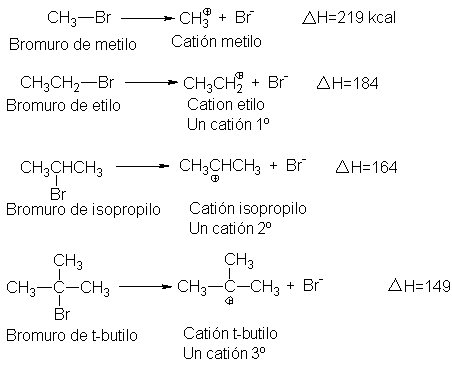
Por definición, esta energía de disociación de enlace es la cantidad
de energía que debe suministrarse para convertir un mol de bromuro de alquilo
en carbocationes y iones bromuro.
![]()
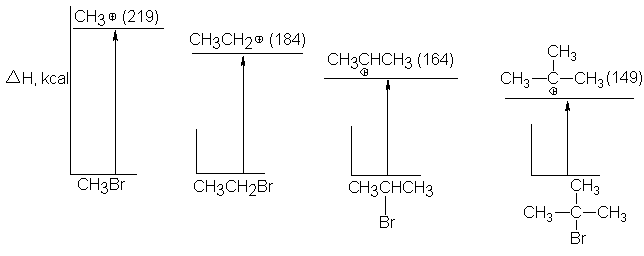
Podemos apreciar que la cantidad de energía necesaria para generar las
diversas clases de carbocationes decrece en el orden:CH3+ > 1º > 2º > 3º.
Si se necesita menor energía para formar un carbocatión que otro, sólo
puede significar que, en relación con el
bromuro de alquilo del cual se forma, un carbocatión contiene menor energía
que el otro, es decir, es más estable
(véase Fig. 5.9).
No intentamos comparar, por ejemplo, los contenidos energéticos
absolutos de los cationes isopropilo y t-butilo, simplemente sostenemos que la
diferencia en energía entre el bromuro de isopropilo y sus cationes
correspondientes es mayor que la diferencia entre el bromuro de t-butilo y sus
carbocationes. Cuando comparamos
estabilidades de carbocationes , comprendemos que nuestro estándar para
cada catión es el sustrato del cual se
deriva. Este tipo de estabilidad que nos interesa lo trataremos más
adelante.
Utilizamos bromuros de alquilo para nuestra comparación, pero
igualmente pudimos emplear fluoruros, cloruros o yoduros de alquilo, o los alcoholes
correspondientes. Las energías de disociación de enlaces de la tabla 1.3
muestran para todos estos compuestos el mismo orden de estabilidad de
carbocationes. Incluso las magnitudes de diferencias energéticas, en kcal/mol,
son casi las mismas, cualquiera que sea la clase de compuestos de origen. La
diferencia entre los cationes metilo y t-butilo, por ejemplo, enr elación con
diversos sustratos, es: fluoruros, 67 kcal; cloruros, 70 kcal; bromuros, 70
kcal; yoduros, 72 kcal, y alcoholes, 66 kcal.
En relación con el sustrato del cual se forma cada uno, el orden de
estabilidad de carbocationes es:
![]()
Descubriremos que este mismo orden no sólo se aplica a los
carbocationes cuando se forman por heterólisis, sino también cuando se forman
mediante procesos enteramente diferentes.
Las diferencias de estabilidad entre carbocationes es mucho mayor que entre radicales libres.
El radical libre t-butilo, por ejemplo, es sólo 12 kcal más estable que el
metilo; el catión t-butilo es, según el sustrato, 66-72 kcal más estable que el
catión metilo. Estas diferencias, mucho mayores, en estabilidad, dan origen a
efectos mucho mayores en la reactividad.
Hasta este momento, nuestro análisis se ha basado en energías de
disociación de enlaces, las cuales se miden en la fase gaseosa. Sin embargo,
casi toda la química de carbocationes se desarrolla en solución y, como
sabemos, los disolventes pueden ejercer efectos estabilizantes poderosos en
solutos iónicos. ¿Es válido el orden de estabilidades establecido para
carbocationes en solutos iónicos.¿Es
válido el orden de estabilidades establecido para carbocationes en solución? Se
da respuesta a esto en forma más directa, midiendo, en varios disolventes, los
H para la generación de carbocationes, utilizando el método del superácido de
Olah. Los valores obtenidos revelan el mismo orden para la estabilidad de
carbocationes, en relación con el sustrato de origen, que las energías de
disociación. Incluso las diferencias en
estabilidad, en kcal/mol, son prácticamente las mismas.
![]()
Hemos logrado así un orden de estabilidades de carbocationes que vale
tanto para soluciones como para la fase gaseosa, y que es aplicable a la
generación de carbocationes con una amplia variedad de sustratos y en una vasta
gama de reacciones químicas. A medida que avancemos nuestro estudio, añadiremos
otros tipos de carbocationes a nuestra serie y examinaremos otros tipos de
reacciones mediante las que pueden ser generados.
Veamos ahora cómo puede justificarse este orden.