Página principal http://organica1.org
19 Reacción SN1: estereoquímica
Seguiremos con la química fundamental de los carbocationes en la
sección 5.20, pero por ahora continuaremos con nuestro planteamiento original,
la sustitución nucleofílica. Veamos un aspecto directamente relacionado con la forma
de los carbocationes: la estereoquímica de la reacción SN1. Según
los estudios estereoquímicos de la
reacción SN2 , la sustitución se efectúa en un sustrato ópticamente
activo. Se aísla el producto y se comparan su configuración y pureza óptica con
las del material de partida. Como antes, deben haberse asignado las
configuraciones relativas del reactivo y del producto, y se deben conocer
también las rotaciones de las muestras ópticamente puras, para poder calcular
las purezas ópticas.
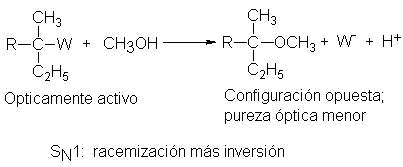
Se ha hecho este tipo de estudios de las reacciones entre varios
sustratos terciarios y el disolvente metanol, CH3OH: reacciones de
un tipo que con toda probabilidad proceden mediante SN1. En cada
caso se obtiene un producto de configuración opuesta de la del material de
partida y de pureza óptica
considerablemente inferior . Un sustrato ópticamente puro da, por ejemplo,
un producto cuya pureza óptica es de sólo el 50% y, en muchos casos, todavía
menor.
El material de partida ópticamente puro sólo contiene uno de los
enantiómeros, mientras que el producto debe contener los dos. El producto es
así una mezcla del compuesto invertido y de la modificación racémica, por lo
que se dice que la reacción procede con inversión más racemización parcial.
Aclararemos bien lo anterior. Consideremos el caso en que un sustrato
ópticamente puro que da un producto con la configuración opuesta y de una
pureza óptica del 50%. De cada 100 moléculas de producto, se forman 75 con
inversión de la configuración y 25, con retención. Las 25 de
configuraciónretenida anulan la rotación de 25 moléculas de configuración
invertida, con lo que queda un exceso de 50 moléculas con configuración
invertida para proporcionar la rotación óptica observada: el 50% del valor
máximo.
Podría decirse que la reacción procede con 75% de inversión y 25% de
retención; de igual manera, podría argumentarse que la reacción procede con 50%
de inversión y 50% de racemización. Sin embargo, esta última forma es la que
generalmente se utiliza: el porcentaje de racemización es, como veremos, una
medida de la aleatoriedad estereoquímica, y el porcentaje de inversión neta (o,
como sucede en ciertos tipos de reacciones, retención neta) es una medida de la
estereoselectividad (.
¿Cómo explicamos la estereoquímica observada para la reacción SN1?
Estudiaremos primero por qué sucede la racemización, y luego, por qué es sólo
parcial y va acompañada de alguna inversión neta.
En una reacción SN2 vimos que el nucleófilo ataca a la
propia molécula de sustrato (haluros14), y la inversión
completa que se observa es una
consecuencia directa de tal hecho: el grupo saliente aun se encuentra ligado al
carbono en el instante del ataque, y dirige el ataque sobre cada molécula de la
misma manera hacia la parte de atrás. Ahora bien, en una reacción SN1,
el nucleófilo no ataca al sustrato, sino al intermediario, el carbocatión: el
grupo saliente se ha desprendido ya, y podría pensarse que no afecta a la
orientación espacial del ataque.
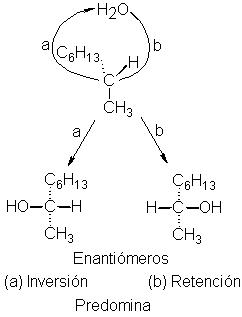
Veamos aqué conduce este razonamiento. El sustrato ópticamente activo
digamos, un halogenuro de alquilo se disocia en el primer paso para formar un
ión halogenuro y un carbocatión. Luego, el reactivo nucleófilo, Z:, se une al
carbocatión. Sin embargo, puede unirse a cualquiera de las caras de este ión
plano y, dependiendo de la cara que elija, da origen a uno u otro de los
productos enantiómeros (véase Fig. 5.8). Los dos enantiómeros juntos
constituyen la modificación racémica. Así, la racemización que acompaña a estas
reacciones es consistente con el mecanismo SN1 y con la formación de
un carbocatión intermedio.
[Hasta aquí, nuestro análisis de acuerdo con lo dicho sobre la
estereoquímica de la cloración por radicales libres, en la que el ataque
aleatorio sobre ambas caras del radical
libre origina, como recordaremos, la racemización total.]
Pues bien, si el ataque a ambas caras del carbocatión fuera puramente
aleatorio, esperaríamos obtener cantidades iguales de los dos enantiómeros, es
decir, sólo la modificación racémica. No obstante, a pesar de que a veces la
racemización es muy elevada 90% o más, casi nuncca es completa y, en general,
el producto invertido excede a su enantiómero: la reacción procede con
racemización más algo de inversión neta.
¿Cómo podemos acomodar incluso
esta inversión neta limitada dentro del marco del mecanismo SN1?
¿Cómo justificamos el hecho de que el ataque al carbocation no sea puramente
aleatorio? Es evidente que el exceso de inversión se debe, de alguna forma, al grupo
saliente: debe ejercer aún cierto control sobre la estereoquímica. En ausencia
completa del grupo saliente, el carbocatión plano perdería toda su quiralidad y
no podría generar un producto con ninguna actividad óptica. (Recuérdese: la síntesis de compuestos
quirales a partir de reactivos aquirales siempre de la modificación racémica.)
¿Cómo está involucrado el grupo saliente? Para hallar una respuesta a
esto, consideremos el proceso de la heterólisis. A medida que la reacción
avanza, la distancia entre carbono y halógeno aumenta progresivamente, hasta
que, finalmente, el enlace covalente se rompe. Se generan los dos iones de
carga opuesta pero no, de inmediato, en forma de iones completamente libres. Inicialmente deben encontarse
muy juntos, lo suficiente para que la atracción electrostática sea apreciable;
existen así por algún tiempo como un par
iónico. Recién formados, los iones se encuentran en contacto mutuo. Luego,
a medida que se alejan por difusión, comienza a intervenir una capa tras otra
de disolvente, hasta que por fin son mutuamente independientes y se habla de
iones <<libres>>.
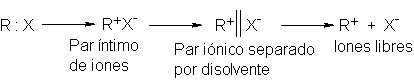
Ahora, el ataque nucleofílico puede suceder en cualquier momento
después de la heterólisis, por lo que puede involucrar a cualquier especie, desde
el par iónico formado inicialmente, hasta el carbocatión libre. El ataque sobre
este último es el azar, dando modificación racémica. Sin embargo, el ataque
sobre el par iónico no es el azar: el anión se encuentra más o menos cerca del
frente del carbocatión, protegiendo así este lado del ataque; el resultado es
el ataque preferencial por atrás. Por tanto, mientras ocurra el ataque antes de
la separación completa del par iónico, la inversión de la configuración compite
con la racemización.
De esta manera, el mecanismo SN1 puede justificar el hecho
de que la racemización no es completa. Pero lo principal es contraste
importante con la estereoquímica SN2 que la racemización suceda
después de todo. A diferencia de una reacción SN2 que procede con
inversión completa, una reacción SN1
lo hace con racemización.
Que haya dos clases de estereoquímica, refuerza la idea central de que
existen dos mecanismos diferentes. El aspecto particular de la estereoquímica
apoya poderosamente los mecanismos específicos mencionados. La inversión
completa en la reacción SN2 afirma la idea de la formación y ruptura
concertada de enlaces, en una sola etapa;
la racemización en la reacción SN1 indica que la formación y ruptura
de enlaces suceden por separado, en etapas
distintas.
El próximo aspecto que estudiaremos de la reacción SN1 es
el problema de la reactividad, para
cuya comprensión debemos volver otra vez a la química de los carbocationes, y
examinar lo que, para nosotros, será su propiedad más importante. Sus estabilidades relativas.