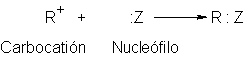Página principal http://organica1.org
Con el fin de explicar los hechos observados, se propuso cierto
mecanismo para la halogenación de los alcanos. El centro de este mecanismo es
la existencia efímera de radicales libres, partículas neutras altamente reactivas
que tienen un electrón no apareado.
Para describir ciertas observaciones de las cuales la cinética de
primer orden tratada en la sección anterior es tan sólo una, se ha propuesto
otra partícula: el carbocatión, un grupo de átomos que contiene un carbono
con seis electrones solamente.
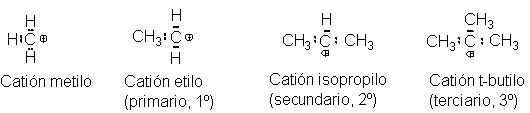
Los carbocationes se clasifican como primarios, secundarios o
terciarios, de acuerdo con el carbono portador de la carga positiva. Se nombran
utilizando la palabra catión.
Por ejemplo:
Debemos estas preparados para encontrarnos con otros dos nombres para
lo que hemos denominado carbocatión. Ión carbonio es casi el único nombre
utilizado en la literatura antigua, siendo aún su empleo muy común, aunque a
veces con un significado especial. Olah (más adelante) ha propuesto que se use
ión carbenio para las especies recién descritas, reservando ión carbonio para especies como el CH5+
(análogas al ión amonio, etc.); el
conjunto de iones carbenio y carbono serían los carbocationes.
AL igual que el radical libre, el carbocation es una partícula muy
reactiva, y por la misma razón: la tendencia a completar el octeto del carbono.
Puesto que en este caso se necesita un par de electrones para completarlo, el
carbono es un ácido de Lewis, y sumamente poderoso. Se distingue del radical
libre por poseer una carga positiva.
Un tipo de carbocatión excepcionalmente estable fue reconocido en 1902
debido al carácter salino de ciertos compuestos orgánicos. No obstante, para
cationes alquilo simple, tal observación directa debe ser muy difícil, debido
precisamente a la reactividad y de ahí su corta vida que se les atribuye. Sin
embargo, durante las décadas del 1920 y 1930 se propusieron cationes alquilo
como intermediarios en muchas reacciones
orgánicas, aceptándose su existencia debido principalmente al trabajo de
tres químicos: Hans Meerwein, de Alemania, el <<padre de la química
moderna del ión carbonio>>; sir Christopher Ingold, de Inglaterra, y
Frank Whitmore, de Estados Unidos. La evidencia consistió en una amplia gama de
observaciones que se hicieron durante el estudio de la química de halogenuros
de alquilo, alcoholes, alquenos y muchos otros tipos de compuestos orgánicos:
observaciones que revelaron un patrón básicamente similar de comportamiento,
atribuido por lógica a carbocationes intermediarios. Una parte importante de
este libro se dedica al estudio de ese patrón.
En 1963, George Olah (ahora en la Universidad de California del Sur)
informó sobre la observación directa
de cationes alquilo simples. Disueltos en el fuertísimo ácido de Lewis SbF5,
se observó que los fluoruros (y, más tarde, otros halogenuros) de alquilo
sufren ionización con formación de un catión, que se estudia con comodidad. Se
observó un cambio drástico en el espectro RMN del espectro del fluoruro de
alquilo al de una molécula que no contiene flúor, sino carbono híbrido sp2
con una densidad electrónica muy baja.
![]()
La figura 5.6 ilustra lo que se observó para el sistema del fluoruro
de t-butilo: un espectro sencillo, pero muy significativo precisamente por su
sencillez. Aunque potencialmente muy reactivo, el catión t-butilo tiene muy
poco que hacer en este ambiente, excepto tratar de recuperar el ión fluoruro y
el SbF5 es un ácido de Lewis aún más fuerte que el catión. Esta es
una reacción ácido-base; el SbF5 (llamado superácido) es un ácido de Lewis aun más fuerte que el catión
alquilo, y mantiene la base ganada, el ión fluoruro.
Por métodos como este, Olah abrió la puerta al estudio no sólo de la propia
existencia de cationes orgánicos de muchos tipos, sino también, de los detalles
íntimos de su estructura.
Puede llevarse a cabo un efecto muy significativo para esta reacción.
Si se diluye la solución que contiene el R+SbF6- con agua, se
obtiene el alcohol, ROH. En esencia con esto tenemos los dos pasos propuestos
para la reacción SN1 la generación de un carbocatión y su
combinación con un nucleófilo, pero observados como procesos discretos,
separados todo el tiempo que deseemos.
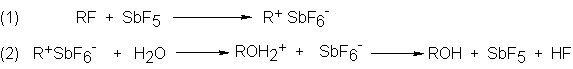
Por tener solamente un sexteto de electrones en su carbono, un
carbocatión es una partícula inestable y altamente reactiva. Como veremos,
puede sufrir una amplia gama de reacciones. Cuál de ellas depende de las
condiciones experimentales. Pero todas las reacciones de un carbocatión tienen
un fin común: proporcionar un par de
electrones para completar el octeto del carbono con carga positiva. En la
segunda etapa de una reacción SN1 probablemente vemos la manera más
directa de lograr esto: la combinación con un nucleófilo, una molécula básica
rica en electrones.