Página principal http://organica1.org
16 Reacción SN1: mecanismo y cinética.
Etapa determinante de la
velocidad
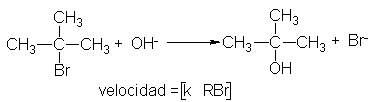
La reacción entre el bromuro de t-butilo y el ión hidróxido para dar
alcohol t-butílico sigue una cinética de primer orden; es decir, la velocidad depende
de la concentración de uno solo de los reactivos: el bromuro de t-butilo.
¿Cómo hemos de interpretar el hecho que la velocidad es independiente
de [OH-]? Si la velocidad de la reacción es independiente de [OH-],
sólo puede significar que la reacción, cuya
velocidad estamos determinando, no involucra OH-
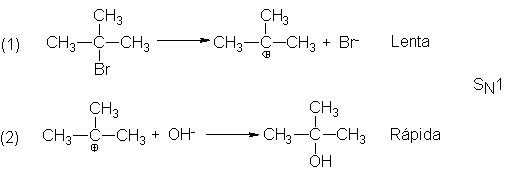
Estas observaciones pueden interpretarse por el siguiente mecanismo:
el bromuro de t-butilo se disocia lentamente (paso 1) en un ión bromuro y en un
catión derivado del grupo t-butilo: un carbocatión.
Este carbocatión se combina ahora (paso 2) velozmente con un ión hidróxido para
generar alcohol t-butílico.
La velocidad de la reacción total queda determinada por la ruptura lenta
del enlace C-Br, para formar el carbocatión, el cual, una vez formado,
reacciona de inmediato para dar el producto. La velocidad que estamos
determinando corresponde a la del paso (1), que no involucra OH-, de
modo que no depende de [OH-]. Una
sola etapa cuya velocidad determinada la velocidad total de un proceso de
varias etapas se denomina etapa
determinante de la velocidad.
No es extraño que el paso que determina la velocidad sea el que
implica la ruptura de un enlace, un proceso que consume energía. Reconocemos
esta ruptura de enlace particular como un ejemplo de heterólisis, escisión en la que ambos electrones enlazantes parten
con el mismo fragmento: un proceso que necesita aún más energía (Sec. 1.14) que
la homólisis que estudiamos en la sustitución por radicales libres. (En la Sec.
6.5 descubriremos de dónde procede toda esta energía.)
Es evidente también que la combinación del carbocatión con el ión
hidróxido es un paso sumamente rápido, puesto que solamente implica la formación de un enlace, un proceso
liberador de energía. Esta combinación puede reconocerse como una reacción
ácido-base en el sentido de Lewis. Sabemos que el ión OH- es una
base fuerte; como veremos, los carbocationes son ácidos de Lewis fuertes.
Este es el mecanismo llamado SN1: sustitución nucleofílica unimolecular. Debido a que la etapa
determinante de la velocidad sólo depende de una molécula, empleamos aquí el
término unimolecular (sin considerar
las muchas moléculas necesarias de disolvente).
No debemos imaginar que las leyes de la química quedan mágicamente
suspendidas para el segundo paso, el rápido. Implica una reacción con OH-
y su velocidad depende de [OH-]. Lo especial aquí es que aumente el
paso (2) se haga más lento por una baja [OH-], sigue siendo mucho más rápido que el paso (1), por lo
que cualquier cambio en su velocidad no afecta la velocidad global.
Veamos lo que queremos decir con etapa determinante de la velocidad
para una reacción como la siguiente,
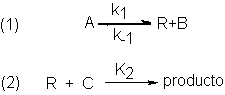
Donde R es un intermedio reactivo (carbocatión, radical libre,
carbanión) cuya concentración se mantiene en un estado estacionario bajo durante toda la reacción. La expresión
cinética para la formación del producto es
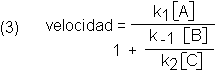
Sin entrar en la derivación de esta expresión, veamos su significado.
El término k1 [A] está en el numerador, y el k2
[C], en el denominador del dominador; cuanto más grandes son mayor es la velocidad. Esto es razonable,
puesto que k1 [A] es la velocidad del paso (1) y k2 [C]
contribuye a la velocidad del paso (2). El término k-1 [B] se
encuentra en el denominador; cuanto mayor es, más lenta es la reacción: esto
también es comprensible, puesto que contribuye a la velocidad del reverso del
paso (1).
Ahora, si resulta que k2 [C] es mucho más grande que k-1 [B], entonces, el término k-1
[B]/k2 [C] es muy pequeño insignificante con respecto a 1-, por lo
que puede despreciarse; en tal caso, resulta la expresión conocida para una
cinética de primer orden:
![]()
Pero si K2 [C] es mucho mayor que k-1 [B],
significa que el paso (2) es mucho más
rápido que el reverso del paso (1). Esta es la verdadera condición para que
el paso (1) sea determinante de la velocidad. ¿Significa lo anterior,
contrariamente a lo dicho, que el paso (1) en su forma directa no necesita ser
más lento que el (2)? El paso (1) debe seguir siendo lento, pues de lo
contrario el intermedio reactivo se generaría más rápidamente de lo que se podría consumir, de modo que su
concentración se iría incrementando, lo que es contrario a la naturaleza del
intermediario reactivo, y es una condición diferente a quélla para la cual vale
la expresión cinética (3).
¿Qué pruebas hay de que los halogenuros de alquilo pueden reaccionar
por medio de este mecanismo? Acabamos de ver que el mecanismo concuerda con la
cinética de primer orden de una reacción como la del bromuro de t-butilo con el
ión hidróxido. En general, una reacción
SN1 sigue una cinética de primer orden. La velocidad de la
reacción completa queda determinada por la velocidad de ionización del
halogenuro de alquilo, de modo que sólo depende de su concentración.
En las siguientes secciones se vería otras evidencias, pero para
entenderlas debemos saber algo más acerca del intermedio que se encuentra en el
meollo del mecanismo y de hecho en el centro de gran parte de la química
orgánica, el carbocatión. Así pues,
dedicaremos un tiempo a seguir dos hebras que se entrelazan por el entramado de la química orgánica:
concentrándonos alternativamente en la sección SN1 y en la química
fundamental de los carbocationes.