Página principal http://organica1.org
15
Reacción SN2: reactividad. Impedimento estérico
Examinemos ahora la reactividad
en la sustitución nucleofílica alifática, y veamos cómo la afectan los cambios
estructurales del grupo alquilo.
De acuerdo con la teoría del mecanismo en 2º, es sencillamente la
mezcla de dos órdenes de reactividad opuestos: uno por SN2, y el
otro por SN1. Una manera de poner a prueba esta hipótesis es
efectuado una sustitución en condiciones tales que todos los miembros de una
serie desde metilo hasta 3º reaccionen en gran medida mediante una cinética de
segundo orden, y midiendo las constantes de velocidad de segundo orden; a
continuación, se repite todo el proceso, seleccionando esta vez condiciones que
favorezcan una reacción de primer orden, con la correspondiente determinación
de las constantes de velocidad de primer orden.
Observemos resultados obtenidos de esta manera: primero, para la
reacción SN2, y más adelante, en otra sección, para la reacción SN1.
Las mediciones directas de velocidades SN2 para una serie
de sustratos detectan resultados como los siguientes. (DMF es dimetilformamida, un disolvente que
favorece la reacción SN2, como veremos en la Sec. 6.4.)
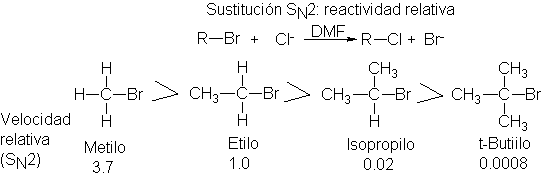
Según lo postulado, la reactividad de los sustratos en la reacción SN2
es:
![]()
¿Cómo podemos justificar este orden de reactividades? Para responder a
una pregunta de este tipo, debemos observar la reacción específicamente implica
en este caso, la reacción SN2 y comparar la estructura de los
reactivos con la del estado de transición esta vez no es intermediaria entre
las de los reactivos y la del producto; esta vez, no podemos esperar que los
factores que estabilizan el producto también lo haga con el estado de
transición.
Durante el desarrollo de muchas reacciones, se produce un cambio en la
distribución electrónica tal que se desarrolla una carga negativa o positiva en
la molécula acomodada esa carga.
A su vez, el acomodo de la carga depende de los efectos polares de los sustituyentes, es decir, de lo efectivos que
sean estos sustituyentes para quitar o
proporcionar electrones. Por tanto, examinemos en primer lugar la reacción SN2
con respecto a cambios en la distribución de los electrones, utilizando
nuevamente como ejemplo la reacción de un halogenuro de alquilo con el ión
hidróxido. Tal como se describió el estado de transición
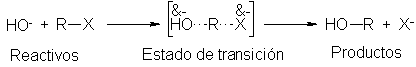
(Sec. 5-13), hay un enlace formado parcialmente entre el carbono y el
ión hidróxido, y otro parcialmente roto entre el carbono y el halógeno; el ión
hidróxido aportó electrones al carbono, mientras que el ión halogenuro se los
quitó. Salvo que alguno de estos
procesos, la formación o la ruptura del enlace, haya progresado mucho más que
el otro, el carbono no es apreciablemente más negativo o positivo que al inicio
de la reacción. Si fuera éste el caso, se concluiría que la secuencia de
reactividades para la reacción SN2 no es el resultado de efectos
polares de los grupos sustituyentes.
Para comprender la influencia de la estructura en la velocidad,
comparemos el estado de transición y los reactivos con respecto a sus formas, comenzando con la reacción del
bromuro de metilo. El carbono en el reactivo y en el producto es tetraédrico,
mientras que en el estado de transición se halla unido a cinco átomos. Como ya
se indicó anteriormente, los enlaces C-H presentan una disposición similar a la
de los radios de una rueda, mientras que lso enlaces C-OH y C-Br están en el
eje (Fig. 5.3).
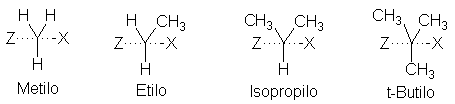
Fig. 5.3 Estructura molecular y reactividad: el factor estérico en la
reacción SN2. La aglomeración eleva la energía del estado de transición y reduce la velocidad de la
reacción.
¿Cuál sería el efecto de reemplazar sucesivamente los hidrógenos por
grupos metilo?
Esto es, ¿cómo diferiría el estado de transición, a medida que
avancemos, del bromuro de metilo al de etilo, luego al de isopropilo, y
finalmente al bromuro de t-butilo? Con el reemplazo paulatino de átomos de
hidrógeno por grupos metilo más voluminosos, va produciéndose una aglomeración creciente
en torno al carbono. Como puede apreciarse con los modelos a escala (Fig. 5.4),
cada vez resulta más inaccesible la parte de atrás de la molécula, donde debe
realizarse el ataque.
Esta aglomeración es particularmente severa en el estado de transición,
en el cual los metilos son forzados a acercarse al OH y al Br (Fig. 5.3). Las
interacciones sin enlaces elevan la energía del estado de transición aglomerado
más que la energía del reactivo, menos congestionado: la Eact es más elevada, y
la reacción, más lenta.
Esta interpretación es la que se acepta generalmente ahora: las diferencias en la velocidad de dos
reacciones SN2 se deben principalmente a factores estéricos, y no a factores polares; es decir, las
diferencias de velocidad tienen relación con el volumen de los sustituyentes, y no con sus efectos sobre la
distribución electrónica. A medida que aumenta el número de sustituyentes
unidos al carbono portador del halógeno, disminuye la reactividad con respecto
a la sustitución SN2, como lo demuestran las mediciones para la
serie metilo, 1º, 2º, 3º.
Que aquí están operando factores estéricos se ve confirmado por las
velocidades relativas de otra serie de sustratos. Esta vez, todos los sustratos
son primarios, por lo que tienen el mismo número
de sustituyentes uno unidos al carbono que tiene el halógeno.
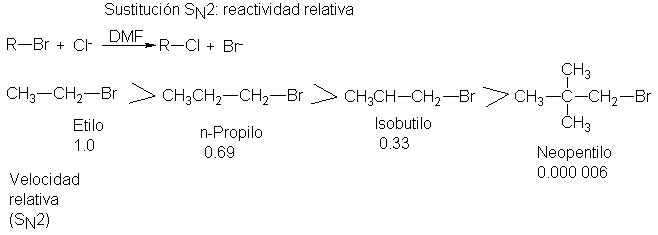
Pero ahora crece constantemente el tamaño
del sustituyente: en el bromuro de etilo, éste es metilo; en el bromuro de n-propilo,
etilo; en el bromuro de isobutilo, isopropilo, y en el bromuro de neopentilo,
el sustituyente es t-butilo. Y a medida que crece el tamaño del sustituyente
(único) aumenta también el impedimento estérico al ataque, de modo que decae la
velocidad. (Véase Fig. 5.5.)
Observamos entonces que el mecanismo SN2 recibe apoyo
mediante tres líneas de evidencia : cinética, estereoquímica y el efecto de la
estructura sobre la reactividad.
Retornaremos más adelante a la reacción SN2, pero por el
momento trataremos otro mecanismo que puede realizar la sustitución
nucleofílica alifática.