Página principal http://organica1.org
14 Reacción SN2:
estereoquímica, Inversión de la configuración
Tanto el 2-bromooctano como el 2-octanol son quirales; es decir, tienen moléculas que
no pueden suponerse a sus imágenes especulares. En consecuencia, estos
compuestos pueden existir como enantiómeros y ser ópticamente activos. Se ha
obtenido el 2-octanol ópticamente activo por resolución de la modificación
racémica , y a partir de él se ha sintetizado el 2-bromooctano activo.
Se han asigando las configuraciones siguientes:

Observamos que el (-)-bromuro y el (-)-alcohol tienen configuraciones
similares, es decir, el OH ocupa en el (-)-alcohol la misma posición relativa
que el –Br en el (-)-bromuro. Como sabemos, los compuestos de configuración
similar no necesariamente rotan la
luz en la misma dirección; en este caso, ocurre que lo hacen. [También sabemos
que compuestos de configuración similar no tienen por qué recibir la misma
especificación R o S; es coincidencia, nuevamente, que en este caso ambos sean
R.]
Al hacer reaccionar (-)-2-bromooctano con hidróxido de sodio en
condiciones que favorecen una cinética de segundo orden, se obtiene
(+)-2-octanol.
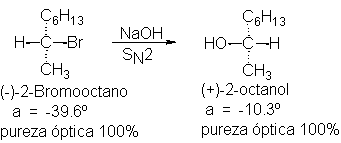
Observamos que el grupo –OH no ha tomado la posición ocupada con
anterioridad por el Br; el alcohol tiene
una configuración opuesta a la del bromuro. Una
reacción que da un producto con configuración opuesta a la del reactivo procede
con inversión de la configuración.
(En este caso particular, la inversión de la configuración va
acompañada, casualmente, de un cambio de especificación, de R a A, pero esto no
siempre es así. No podemos determinar si una reacción procede con inversión o
retención de configuración inspeccionando simplemente las letras empleadas para
especificar al reactivo y al producto: debemos establecer y comprar las
configuraciones absolutas indicadas por tales letras.)
Surge ahora la pregunta: ¿procede una reacción como ésta con inversión
completa?
Es decir, ¿se invierte la configuración de todas las moléculas? La
respuesta es sí. Una reacción SN2 procede con inversión estereoquímica
completa.
Para responder a una pregunta como ésta, debemos conocer la pureza
óptica del reactivo del que partimos y del producto que obtenemos; en este
caso, el 2-bromooctano y el 2-octanol. Para conocer éstos, a su vez, debemos
saber cuál es la rotación máxima del bromuro y la del alcohol; es decir,
debemos conocer la rotación de una muestra ópticamente pura de cada uno de
ellos.
Por ejemplo, supongamos que sabemos que la rotación máxima del
2-bromooctano ópticamente puro es 39.6º y que la del 2-octanol ópticamente
puro, sabemos que la reacción procedió con inversión completa. O bien y esto es
más práctico, si una muestra del halogenuro de rotación –32.9º, por ejemplo
(pureza óptica 83%), diera alcohol de rotación +8.55º (pureza óptica 83%),
también sacaríamos la misma conclusión.
Durante el desarrollo de las ideas de las reacciones SN1 y
SN2, Hughes e Ingold estudiaron la reacción del 2-bromooctano
ópticamente activo y obtuvieron resultados que les llevaron a concluir que la
reacción SN2 procede, dentro de los límites del error experimental,
con inversión completa.
El valor específico que Hughes e Ingold utilizaron para la rotación
del 2-bromooctano ópticamente puro ha sido puesto en duda, pero la idea básica
de la inversión completa en reacciones SN2 se ha establecido más
allá de toda duda: por medio del estudio de sistemas distintos de los
halogenuros de alquilo y por medio de un elegante trabajo sobre radiactividad y
actividad óptica.
El ataque por atrás en la sustitución del tipo SN2 se
propuso originalmente para justificar la
inversión de la configuración. A medida que el OH se va uniendo al carbono,
tres enlaces se ven forzados a separarse hasta alcanzar la disposición radial
del estado de transición; luego, al expulsarse el bromuro, siguen desplazándose
hasta alcanzar una disposición tetraédrica opuesta
a la original. Este proceso se compara a menudo
con el paraguas que se da vuelta en un temporal.
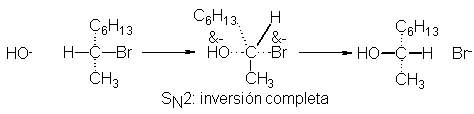
La estereoquímica de la reacción del 2-bromooctano indica ataque por
atrás de acuerdo con el mecanismo SN2; estudio de otros compuestos ópticamente
activos, en condiciones en las que las reacciones siguen una cinética de
segundo orden, muestran resultados similares. No es posible estudiar la estereoquímica
de la mayoría de los halogenuros, puesto que no son ópticamente activos, sin
embargo no hay razón para dudar que también ellos sufren ataque por atrás.
La inversión de la configuración es la regla general para reacciones
que suceden en centros quirales, y es mucho más común que la retención de la
configuración. Extrañamente, la frecuencia de la inversión fue la causa de su
difícil descubrimiento. Paul Walden (Politécnico de Riga, Letonia) descubrió el
fenómeno de la inversión en 1896, cuando encontró una de las reacciones
excepcionales, en la cual la inversión no sucede.
Aparte de la orientación espacial del ataque, hay otra característica
de la sustitución SN2 aún más fundamental, puesto que define el
mecanismo: la reacción sucede en una sola
etapa, de modo que la ruptura y formación de enlaces ocurren
simultáneamente, de una manera concertada.
También esta característica se apoya en la estereoquímica: no por el hecho de
que hay inversión, sino porque ésta es completa.
Cada molécula del sustrato sufre el mismo destino estereoquímico inversión,
como es el caso. Esta especificidad es consistente con el mecanismo: el grupo
saliente todavía se encuentra ligado al carbono cuando comienza el ataque
nucleofílico, controlado así la dirección del ataque. (Apreciaremos mejor la
importancia de este aspecto al ver el contraste que ofrece la reacción SN1.)
De hecho, ya hemos encontrado una situación de contraste: la cloración por radicales
libres 1-cloro-2-metilbutano ópticamente activo. Se extrae primero hidrógeno
del centro quiral; luego, en un paso posterior, se une cloro al carbono. Sin
embargo, una vez que el hidrógeno se fue, no queda nada que pueda dirigir el
cloro hacia una cara en particular del carbono: el ataque ocurre al azar en
ambas caras, de modo que resulta la modificación racémica.
En consecuencia, el mecanismo SN2 está apoyado en pruebas
estereoquímicas. De hecho, la relación entre mecanismo y estereoquímica está
tan bien establecida que, en ausencia de otra evidencia, se considera que una inversión
completa indica una reacción SN2.
Podemos apreciar, una vez más,
que la estereoquímica puede proporcionar un tipo de información acerca
de una reacción que no es posible obtener
por otros medios.