Página principal http://organica1.org
13 Reacción SN2:
mecanismo y cinética
La reacción entre el bromuro de metilo y el ión hidróxido para dar
metanol sigue una cinética de segundo orden; es decir, su velocidad depende de
ambos reactivos:
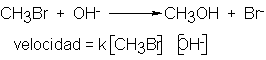
La forma más simple de definir la
cinética es suponer que la reacción requiere una colisión entre un ión
hidróxido y una molécula de bromuro de metilo. Por las evidencias que
estudiaremos en breve, se sabe que el ión hidróxido permanece lo más alejado
posible del bromo durante el ataque, o sea, el ión ataca a la molécula por
atrás.
Se cree que la reacción sucede como se indica en la figura 5.2 Cuando
el ión hidróxido choca con una molécula de bromuro de metilo en la cara más
remota del bromo, y con energía suficiente, se forma un enlace C-OH y se rompe
el enlace C-Br, liberándose el ión bromuro.
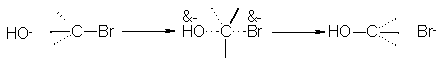
Fig. 5.2 Reacción SN2: inversión completa de la
configuración. El reactivo
Nucleofílico ataca la parte de atrás.
El estado de transición puede representarse como una estructura en la
que el carbono está parcialmente unido al –OH y al –Br; aún no se ha formado
por completo el enlace C-OH, ni se ha
roto en su totalidad el enlace C-Br. Ha disminuido la carga negativa del
hidróxido, porque ha comenzado a compartir sus electrones con el carbono. El
bromo ha comenzado a desarrollar una carga negativa parcial, ya que ha
eliminado en parte un par de electrones del carbono.
El –OH y el –Br se ubican lo más apartados posibles: los tres hidrógenos y el carbono se
encuentran en un solo plano, y todos sus ángulos de enlace son de 120º. En
consecuencia, los enlaces C-H se distribuyen como los rayos de una rueda, con
los enlaces C-OH y C-Br ubicados a lo largo de su eje.
Podemos observar cómo se alcanza la geometría del estado de
transición. El carbono sujeta a los tres hidrógenos por medio del solapamiento
de tres orbitales sp2, que son trigonales y, por tanto, planos, y
están alejados 120º. Los enlaces parciales con el grupo saliente y con el
nucleófilo se forman por el solapamiento de vestigios de los orbitales p,
restantes, separados 180º y perpendiculares al plano de los orbitales sp2.
Este es el mecanismo denominado SN2: sustitución nucleofílica bimolecular. Se emplea aquí el término
bimolecular, porque la etapa que determina la velocidad implica la colisión de
dos partículas.
¿Qué evidencia hay de que los halogenuros de alquilo reaccionen de
esta manera? En primer lugar, acabamos de ver que este mecanismo es compatible
con una cinética de reacción como la del bromuro de metilo con ión hidróxido.
En general, una reacción SN2
sigue una cinética de segundo orden. Analicemos otras evidencias.