Página principal http://organica1.org
11 Cinética de la
sustitución nucleofílica alifática.
Reacciones de segundo y
primer orden
Tomemos como ejemplo específico la reacción del bromuro de metilo con
hidróxido de sodio
Para generar metanol:
![]()
Esta reacción probablemente se llevaría a cabo en etanol acuoso, en el
que ambos reactivos son solubles.
Si la reacción es el resultado de la colisión entre un ión hidróxido y
una molécula de bromuro de metilo, esperaríamos que la velocidad dependa de la
concentración de ambos reactivos. Si dobláremos la concentración de OH-,
[OH-], o la del CH3Br, [CH3Br], debería
duplicarse la frecuencia de colisiones y
en consecuencia, su velocidad. Si cualquiera de las concentraciones se reduce a
la mitad, también debería reducirse a la
mitad el número de colisiones y, por consiguiente, la velocidad.
Lo expuesto puede comprobarse experimentalmente. Se dice que la
velocidad de la reacción depende tanto de [OH-] como de CH3Br,
y viene expresada por
![]()
Si las concentraciones se expresan en moles por litro, por ejemplo,
entonces K es el número que, multiplicado por estas concentraciones, indica
cuántos moles de metanol se forman en cada litro por segundo. Para una
temperatura y un disolvente dados, k siempre tiene el mismo valor y es
característico de esta reacción específica; k se denomina constante de velocidad. Así, para la reacción entre el bromuro de
metilo y el ión hidróxido en una mezcla de 80% de etanol y 20% de agua a 55ºC,
el valor de k es 0.0214 litros por mol por segundo.
Por supuesto, no debe sorprendernos lo que se acaba de exponer.
Sabemos que un incremento de concentración ocasiona un aumento de la velocidad.
Pero veamos ahora la reacción correspondiente entre el bromuro de t-butilo y el
ión hidróxido:
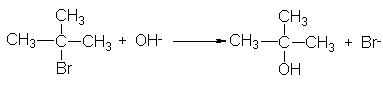
Si, como antes, duplicamos [RBr], también se duplica la velocidad; si
reducimos [RBr] a la mitad, decrece la velocidad en la misma proporción. En
cambio, si duplicamos [OH-] o lo reducimos a la mitad, no hay cambio
en la velocidad: la velocidad de la
reacción es independiente de [OH-].
La velocidad de la reacción del bromuro de t-butilo depende sólo
[RBr]. Esto se indica por la expresión
![]()
Para la reacción del bromuro de t-butilo en alcohol al 80% y a 55ºC,
la constante de velocidad es 0.010 por segundo, lo que significa que por cada
mol de bromuro de t-butilo presente, cada segundo reacciona 0.010 mol,
cualquiera que sea la concentración de [OH-].
Se dice que la reacción del bromuro de metilo sigue una cinética de segundo orden, puesto que
su velocidad depende de las concentraciones de dos sustancias. La del bromuro
de t-butilo, en cambio, sigue una cinética
de primer orden, pues su velocidad depende de la concentración de una sola sustancia.