Página principal http://organica1.org
3
Fuentes industriales de los
éteres. Deshidratación de alcoholes
Varios éteres
simétricos con grupos
alquilo menores se
preparan en gran
escala, principalmente para uso
como disolventes. El
más importante de
éstos es el dietil
éter, el disolvente empleado
comúnmente en la
extracción y preparación
de los reactivos
de Grignard; otros
son el diisopropil
éter y el
di-n-butil éter.
Estos éteres
se preparan por reacción de los
alcoholes correspondientes con
ácido sulfúrico. Al perderse
una molécula de agua
por cada par de moléculas
de alcohol, esta
reacción es una
especie de deshidratación. La
deshidratación para dar
éteres en vez
de alquenos se controla
por la elección de
las condiciones de
reacción. Por ejemplo,
se
![]()
Prepara etileno por calentamiento de alcohol etílico
con ácido sulfúrico concentrado
a 180ºC; el dietil
éter, en cambio,
se prepara por
calentamiento del mismo
alcohol a 140ºC,
agregando continuamente etanol
para mantener el
exceso.
La
deshidratación se suele
limitar a la
preparación de éteres
simétricos, ya que
una combinación de
dos alcoholes da
normalmente una mezcla
de tres éteres.
La formación
de éteres por
deshidratación es un
ejemplo de susttución
nucleofílica que tiene
como sustrato al
alcohol protonado, y
como nucleófilo, una
segunda molécula de
alcohol.
La mayoría
de los
éteres alifáticos se
convierten lentamente en peróxidos
al contacto con el aire.
Aunque están presentes
en concentraciones bajas,
estos peróxidos son
muy peligrosos, puesto
que son inestables
y pueden producir
explosiones violentas durante
las destilaciones que
normalmente siguen a
las extracciones con
éter.
La presencia
de peróxidos se
detecta por la
formación de una coloración roja
cuando se agita
el éter con
una solución acuosa
de sulfato ferroso-amóniaco y
tiocianato de potasio;
el peróxido oxida
el ion ferroso
a férrico, que
reacciona con el ión tiocianato para
dar el color
rojo sangre característico del ion complejo.
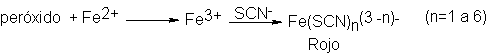
Hay varias formas
de eliminar los
peróxidos de los
éteres, incluyendo un
lavado con soluciones
de ión ferroso
(que reduce lso peróxidos) o
la destilación con ácido sufúrico concentrado
que los oxida)
Para emplearlo
en la preparación de reactivos de Grignard, el éter (generalmente el
dietílico) debe estar libre
de vestigios de
agua y alcohol.
El lamado éter absoluto
se puede preparar
por destilación del
éter ordinariio con H2S4 concentrado (que no sólia eliminar agua y
alcohol, sino también
los peróxidos) y guardar luego sobre sodio metálico. Comercialmente existe
éter anhidro de
tan buena calidad que
sólo necesita tratamiento con sodio para adecuarse a
la reacción de Grgnard.
El uso de
detil éter es
muy peligroso, aun
cuando esté libre
de peróxidos: es muy
volátil, y la
inflamabilidad de sus vapores,
a menos que
se observen las precauciones
adecuadas, supone un
riesgo permanente de
explosión e incendio.