Página principal http://organica1.org
13
Escisión de los epóxidos
catalizada por ácidos.
Hidroxilación anti
Como otros
éteres, los epóxidos
se protonan mediante
ácidos; los epóxidos
así protonados pueden
ser atacados por
diversos reactivos nucleofílicos.
Un aspecto
importante de las
reacciones de los
epóxidos es la
formación de compuestos
con dos grupos funcionales.
Así, la reacción con
agua genera un
1,2-diol, y con
un alcohol, una
sustancia que es éter
y alcohol a la
vez.
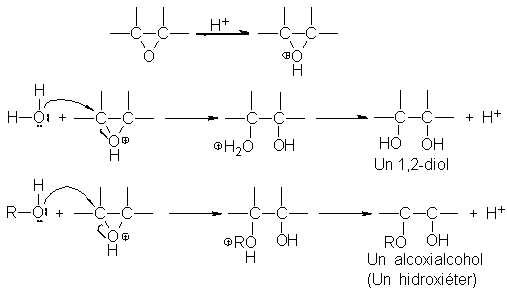
El proceso
de dos etapas de
la epoxidación segunda
de hidrólisis es
estereoselectiva y da
1,2-dioles que corresponden
a una adición
anti al
doble enlace carbono-carbono. Se
ha observado exactamente
la misma estereoquímica para
la hidroxilación de
alquenos con ácido
peroxifórmico y por
una buena razón:
también allí se
forma un epóxido,
pero se escinde
rápidamente en el
medio ácido, el
ácido fórmico. La explicación
es la misma
dada por la
adición anti de los
halógenos. En realidad, los
epóxidos y su
hidrólisis sirvieron de
modelo para formular
el mecanismo del
ion halogenonio.
La hidroxilacíon
con permanganato da
adición syn. Para justificar esta estereoquímica, se
ha propuesto la
formación de un
intermediario del tipo I:
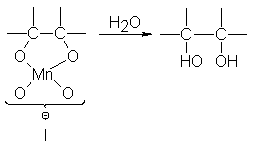
La hidrólisis
de dicho intermediario
daría un cis-diol. Este
mecanismo se sustenta
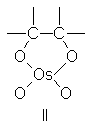
en el hecho de
que el tetróxido de
osmio, OsO4, que
también genera un
cis-glicol, forma efectivamente
intermediarios estables de
estructura II.
Por tanto,
los dos métodos
de hidroxilación con
peroxiácidos y con
permanganato difieren
estereoquímicamente. Tienen mecanismos
diferentes.