Página principal http://organica1.org
ETERES
1. Escriba fórmulas
estructurales para:
(a) dimetil éter (h)
di-B-cloroetil éter
(b) diisopropil éter (i) anisol
(c) n-butil metil éter (j) fenetol
(d) t-butil isobutil éter (k) difenil éter
(e) 3-metoxihexano (l) óxido de ciclohexeno
(f) divinil éter (m)
p-nitrobencil n-propil éter
(g) dialil éter (n)
1,2-epoxipentano
2. Nombre las
estructuras siguientes:
(a) (CH3)2CHCH2-O-CH2CH(CH3)2 (e) p-BrC6H4OC2H5
(b) CH3-O-CH(CH3)2 (f) o-O2NC6H4CH2OC6H5
(c) (CH3)3C-O-CH2CH3 (g) 2,4-Br2C6H3OCH3
(d) CH3CH2CH2CH(OCH3)CH2CH2CH3
3. Desarrolle una
posible síntesis de laboratorio para cada uno de los siguientes compuestos,
desde alcoholes y fenoles:
(a) t-butil metil éter (d) bencil
p-toluil éter
(b) fenetol (C6H5OC2H5) (e) isobutil
isopropil éter
(c) n-butil ciclohexil éter (f) t-butil
isopropil éter
(g) dimetil éter del resorcinol (1,3-dimetoxibenceno)
4. Acomode los
compuestos de cada conjunto por orden de reactividad con el bromo:
(a) anisol, benceno,
clorobenceno, nitrobenceno, fenol
(b) anisol,
m-hidroxianisol, o-metilanisol, m-metilanisol
(c) p-C6H4(OH)2,
p-CH3OC6H4OH, p-C6H4(OCH3)2
5. Escriba una ecuación
balanceada para cada una de las siguientes reacciones. (De no haberla, indique << no hay reacción>>)
(a) t-butóxido de
potasio + yoduro de etilo
(b) yoduro de t-butilo +
etóxido de potasio
(c) alcohol etílico + H2SO4
(140ºC)
(d) di-n-butil éter +
NaOH acuoso, hirviente
(e) etil metil éter + HI
exceso (caliente)
(f) dimetil éter + Na
(g) dietil éter + H2SO4
concentrado, frío
(h) dietil éter + H2SO4
concentrado, caliente
(i) C6H5OC2H5
+ HBr concentardo, caliente
(j) C6H5OC2H5
+ HNO3, H2SO4
(k) p-CH3C6H4OCH3
+ KMnO4 + KOH + calor
(l) C6H5OCH2C6H5
+ Br2, Fe
6. Al igual que otros
compuestos oxigenados, el n-butil t-butil éter se disuelve en H2SO4
concentrado y frío. Sin embargo, al abandonar la solución, se separa lentamente
una capa insoluble en el ácido, constituida por material hidrocarbonado de
elevado punto de ebullición. ¿Cuál puede ser este material? ¿Cómo se forma?
7. El óxido de propileno
utilizado para obtener los polímeros descritos en el problema 19.23 (Sec. 9.14),
puede manufacturarse con propileno por la acción de hidroperóxido de t-butilo,
t-BuO-O-OH.
(a) Como suele ser el
caso en procesos industriales, éste resulta económico sólo si hay un
subproducto comercializable. ¿Cuál es el subproducto que se forma en este caso?
(b) El hidroperóxido de
t-butilo se forma por una reacción en cadena a temperatura elevada entre el
isobutano y O2. Sugiera una serie de pasos probables para esta
reacción.
(c) La oxidación con
aire de un alqueno a su epóxido, reacción que se usa para la manufactura del
óxido de etileno (Sec. 19.11), no puede emplearse en la obtención de óxido de
propileno. ¿Por qué es probablemente así? [Indicación: Recurra a su respuesta para el apartado (b).]
8. Describa ensayos
químicos simples que distingan entre:
(a) di-n-butil éter y
alcohol n-pentílico (e)
anisol y tolueno
(b) dietil éter y yoduro
de metilo (f)
divinil éter y dietil éter
(c) metil n-propil éter
y 1-penteno (g) n-butil
t-butil éter y n-octano
(d) diisopropil éter y
dialil éter
9. Se cree que un
compuesto desconocido es uno de los enumerados a continuación. Describa cómo
procedería para detectar cuál de las posibilidades es realmente la sustancia
desconocida. Cuando sea posible utilícense ensayos químicos sencillos y cuando
sea necesario, métodos químicos más complicados como hidrogenación catalítica,
degradación, etc. Utilícense las tablas de constantes físicas necesarias.
(a) di-n-propil éter
(p.e. 91ºC) y 2-metilhexano (p.e. 91ºC)
(b) bencil etil éter
(p.e. 188ºC) y alil fenil éter (p.e. 192ºC)
(c) metil p-toluil éter
(p.e. 176ºC) y metil m-toluil éter (p.e. 177ºC)
(d) etil n-propil éter
(p.e. 64ºC), 1-hexeno (p.e. 64ºC) y metanol (p.e. 65ºC)
e) anisol (p.e. 154ºC),
bromobenceno (p.e. 156ºC), o-clorotolueno (p.e. 159ºC),
n-propilbencilo (p.e. 159ºC) y
ciclohexanol (p.e. 162ºC)
(f) dietil éter (p.e.
35ºC), n-pentano (p.e. 36ºC) e isopreno (p.e. 34ºC)
(g) metil o-toluil éter
(p.e. 171ºC), fenetol (p.e. 172ºC y diisopentil éter (p.e. 173ºC)
10. Dé las estructuras y
nombres de los productos que resultan de la reacción entre el óxido de etileno y:
(a) H2O, H+ (I)
HCOOH
(b) H2O, OH- (j)
C6H5MgBr
(c) C2H5OH, H+ (k) NH3
(d) producto de (c), H+ (l) dietilamina (C2H5NHC2H5)
(e) HOCH2CH2OH,
H+ (m)
fenol, H+
(f) producto de (e), H+ (n) fenol, OH-
(g) HBr anhidro (o)
HC=C-Na+
(h) HCN
11. Puede convertirse
óxido de propileno en 1,2 propanodiol por la acción de un ácido o una base
diluidos. Cuando se usa óxido de propileno ópticamente activo, el 1,2-diol,
obtenido por hidrólisis ácida, tiene rotación opuesta a la quese logra por
hidrólisis alcalina. ¿Cuál es la interpretación probable para estos resultados?
12. (a) Escriba fórmulas
para todos los estereoisómeros de I.
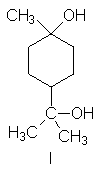
(b) Indique qué
isómeros, una vez separados de todos los demás, serán ópticamente activos y
cuáles serán anactivos. (c) Uno de estos estereoisómeros se convierte muy
fácilmente en un éter, C10H18O. ¿Cuál es este isómero y
cuál es la estructura del éter?
13. Dé las estructuras
(incluyendo configuraciones donde corresponda) de los compuestos A-M:
(a)
CH2=CH2 + CI2/H2O ®
A (C2H5OCI)
A + H2SO4 + calor ®
B(C4H8OCI2)
B + alcohölico KOH ® C(C4H6O)
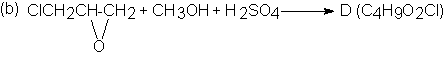
D + NaOCI ® CHCI3 + E (C3H6O3)
D
+ NaOH (ac) ®
F (C4H8O2)
(c) CICH2CH2CH2OH
+ KOH ®
G (C3H6O)
(d) CH2=CHCH2CH2CH2OH
+ Hg(OAc)2 + H2O, luego NaBH4 ®
H (C5H10O)
(e) oxido de ciclohexeno
+ HCI anhidro ® I (C6H11OCI)
(f) 1-metilciclohexeno +
HCO2OH ® J (C7H14O2)
(g) 3,4-epoxi-1-buteno
racémico + KMnO4 alcalino,
frío, luego ácido diluido ® K (C4H10O4)
(h) cis-2-buteno + CI2/H2O,
luego OH-, luego diluido ® L (C4H10O2)
(i) trans-2-buteno,
tratado como en (h) ® M (C4H10O2)
14. Una feromona de
insectos ya mencionada, se ha obtenido de la siguiente manera. (Información
útil: Un alcohol, ROH, se convierte, a menudo, en su acetato, CH3COOR,
por medio de un tratamiento con cloruro de acetilo, CH3COCI.)
1,8-octanodiol + HBr
® N (C8H17OBr)
N + DHP + H+ ® O (C13H25O2Br)
O + HC=CLi ® P (C15H26O2)
P + LiNH2; luego C2H5Br ® Q (C17H30O2)
Q + H2O, H+ ® R (C12H22O)
R + CH3COCI ®
S (C14H24O2)
S + H2, catalizador de Lindlar ® la feromona (C14H26O2)
(a) Dé la estructura de
la feromona y de todos los compuestos intermediario.
(b) Para que la
actividad biológica sea máxima debe
estar presente un 4% de su isómero geométrico. ¿Cómo podría modificarse
la síntesis descrita para obtener dicho
isómero?
15. El atrayente sexual
de la polilla del gusano del maíz es una mezcla a partes casi iguales de dos
isómeros geométricos denominada gossyplure. Uno de los componentes se ha
sintetizado de la siguiente manera,
(Información útil: Un alcohol, ROH, se convierte a menudo en su acetato,
CH3COOR, por medio de un tratamiento con cloruro de acetilo, CH3COCI.)
1-hexino + n-BuLi; luego
óxido de etileno; luego H+ ® T (C8H14O)
T + H2, catalizador de Lindlar ® U (C8H16O)
U + PBr3 ® V (C8H15Br)
6-bromo-1-hexanol + DHP + H+ ® W (C11H21O2Br)
W + HC=CLi ® X (C13H22O2)
X + n-BuLi; luego V ® Y (C21H36O2)
Y + H2, catalizador de Lindlar ® Z (C21H38O2)
Z + H2O, H+ ® AA (C16H30O)
AA + CH3COCI ® la feromona (C18H32O2)
(a) ¿Cuál es la
estructura de la feromona recién sintetizada?
(b) Esta síntesis se ha
modificado para obtener cada uno de los isómeros geométricos del compuesto del
apartado (a), uno de los cuales es el otro componente de la feromona natural.
Indique cómo podría lograrse este este
objetivo.
16. Proponga una
estructura, o estructuras, para el compuesto cuyo espectro infrarrojo se
ilustra en la figura 19.4 Si se
encuentra más de una estructura congruente con el espectro, ¿podría decidir
entre las posibilidades basándose en el espectro RMN protónica? ¿Y en el
espectro RMC? Indique lo que se esperaría observar en cada caso.
17. Proponga una
estructura, o estructuras, para el compuesto BB, cuyos espectros ,infrarrojo y
RMN protónica se ilustran en la figura 19.5.
18. Proponga una
estructura, o estructuras, congruente con cada uno de los espectros RMN
protónica de la figura 19.6.
19. Proponga una
estructura, o estucturas, congruente con cada uno de los espectros RMC de la
figura 19.7.
20. Proponga las
estructuras de los compuestos CC, DD y EE basándose en sus espectros infrarrojo
(fig. 19.8) y RMN protónica (Fig. 19.9.)