AMINAS http://organica1.org/qo1/ok/aminas/aminas.htm
Página
principal http://organica1.org
Amonólisis de
halogenuros
Muchos compuestos
orgánicos halogenados se
convierten en aminas
por tratamiento con
soluciones acuosas o
alcohólicas de amoniaco.
Comúnmente, la reacción
se realiza por
un contacto prolongado
de los reactivos
a temperatura ambiente
o por calentamiento
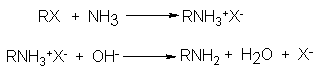
bajo presión, El desplazamiento del
halógeno por NH3
genera la sal
de amina, de
la que esta
última puede liberarse
por un tratamiento
con ion hidróxido.
La amonólisis
de halogenuros pertenece
al tipo de
reacciones que denominamos
sustitución nucleofílica. El
halogenuro orgánico es
atacado por el
amoniaco nucleofílico del
mismo modo que
lo es por
los iones hidróxido,
alcóxido, cianuro acetiluro
y la molécula
de agua:
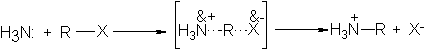
Al igual
que estas reacciones
de sustitución nuclñeofílica
mencionadas, la amonólisis se
circunscribe sobre todo
a los halogenuros
de alquilo o
a halogenuros de
alquilo sustituidos. Además,
la eliminación tiende
a competir con
la sustitución, como
sucede con otras
reacciones de este
tipo: el amoniaco
puede atacar a
un hidrógeno para
formar un alqueno,
y a un
carbono para formar
una amina. Por consiguiente,
la amonólisis da
los rendimientos más
elevados con halogenuros primarios (donde
predomina la sustitución)
y es prácticamente
inútil para los terciarios
(donde predomina la
eliminación).
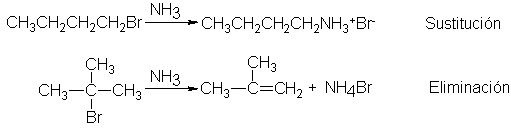
Debido a
la reactividad muy baja de
los halogenuros de arilo,
éstos sólo pueden
convertirse en aminas,
si (a) el
anillo contiene grupos
-NO2 u otros
que atraen fuertemente electrones,
en posiciones orto y para
con respecto al halógeno,
o (b) si
se emplea una
temperatura elevada o un reactivo
muy básico.
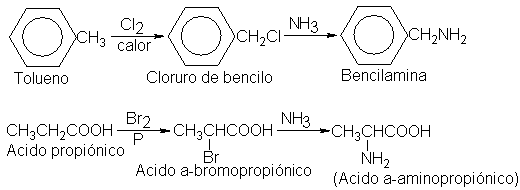
Algunos ejemplos
de la aplicación
de la amonólisis a
la síntesis son:
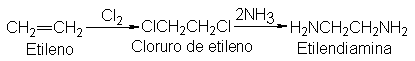
Una desventaja
seria de la
síntesis de aminas
por amonólisis es
la formación de más de
un tipo de
amina. La sal de
amina primaria, formada
por la sustitución
inicial, reacciona con
![]()
Más amoniaco
para liberar la
amina primaria y
formar la sal de
amonio; se establece
el equilibrio siguiente:
![]()
La amina
primaria libre es
un reactivo nucleófilo,
como lo es el
amoniaco del cual
proviene, por lo
que también puede
atacar al halogenuro de alquilo apra
generar la sal de
una amina secundaria:
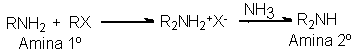
La amina
secundaria, que está en
equilibrio con su
sal, puede, a
su vez, atacar
al halogenuro de
alquilo para producir
la sal de
una amina terciaria:
![]()
Finalmente, la
amina terciaria puede
atacar al halogenuro
de alquilo para
formar un compuesto
de fórmula R4N+X-,
llamado sal de
amonio cuaternaria:
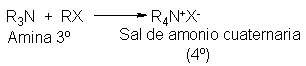
La presencia
de un gran
exceso de amoniaco
rebaja la importancia
de estas últimas
reacciones y aumenta
el rendimiento en
amina primaria. En
dichas condiciones, una molécula de
halogenuro de alquilo
tiene mayores posibilidades
de chocar y
reaccionar con una
de las numerosas
moléculas de amoniaco
que con una de
las relativamente escasas
moléculas de amina.
En el mejor
de los casos,
baja el rendimiento en
amina primaria debido
a la formación
de los otros
tipos de aminas.
Salvo en el
caso especial de
la metilamina, la
amina primaria puede
separarse de los
subproductos por destilación.