Página
principal http://organica1.org
1. Descartando la
enantiomería, dé fórmulas estructurales, nombres comunes e IUPAC , para:
(a) los siete compuestos
carbonílicos de fórmula C5H10O
(b) los cinco compuestos
carbonílicos de fórmula C8H8O que contienen un alilo
bencénico
2. Dé la fórmula
estructural de:
(a) acetona (k)
3-metil-2-pentanona
(b) benzaldehído (l) 2-butenal
(c) isobutil metil cetona (m) 4-metil-3-penten-2-ona
(óxido de mesitilo)
(d) trimetilacetaldehído (n)
1,3-dilenil-2-propen-1-ona (benzalacetofenona)
(e) acetofenona (o)
3-hidroxipentanal
(f) cinamaldehído (p) bencil fenil
cetona
(g) 4-metilpentanal (q)
salicilaldehído
(h) fenilacetaldehído (r)
p,p’-dihidroxibenzofenona
(i) benzofenona (s)
m-tolualdehído
(j)
a,y-dimetilcaproaldehído
3. Escriba ecuaciones
balanceadas, nombrando todos los productos orgánicos, para la reacción (de
haberla) del fenilacetaldehído con:
(a) reactivo de Tollens (i) cloruro de
isopropilmagnesio, luego H2O
(b) CrO3/H2SO4 (j) HC=CLi,
luego H2O
(c) KMnO4 diluido,
frío (k) CN-, H+
(d) KMnO4, H+,
calor (l)
hidroxilamina
(e) H2, Ni,
1,3 atm, 30ºC (m)
fenilhidrazina
(f) LiAlH4 (n)
2,4-dinitrofenilhidrazina
(g) NaBH4 (o)
semicarbazida
(h) C6H5MgBr,
luego H2O (p) alcohol etílico,
HCI (g) seco
4. Responda al problema 3
para ciclohexanona.
5. Escriba ecuaciones
balanceadas, nombrando todos los productos orgánicos, para las reacciones (de
haberlas) del benzaldehído con:
(a) NaOH concentrado (e) CH3MgI,
luego H2O
(b) formaldehído, NaOH
concentrado (f) producto
(e) +
H+, calor
(c) CN-, H+ (g)
(CH3)2 14CHMgBr, luego H2O
(d) producto (c) + H2O,
H+, calor (h)
H2 18O, H+
6. Escriba ecuaciones
para todos los pasos de la síntesis de los siguientes compuestos, comenzando
con propionaldehído y utilizando cualquier reactivo necesario:
(a) alcohol n-propílico (e)
1-fenil-1-propanol
(b) ácido propiónico (f)
etil metil cetona
(c) ácido
a-hidroxibutírico (g)
propionato de n-propilo
(d) alcohol sec-butílico (h)
2-metil-3-pentanol
7. Escriba ecuaciones
para todos los pasos de la síntesis de los siguientes compuestos con
acetofenona, usando cualquier reactivo necesario:
(a) etilbenceno (d)
2-fenil-2-butanol
(b) ácido benzoico (e)
1,1-difeniletanol
(c) alcohol
a-feniletílico (f)
ácido a-hidroxi-a-fenilpropiónico
8. Desarrolle todos los
pasos para una posible síntesis de laboratorio de cada uno de los siguientes
compuestos, desde benceno, tolueno y alcoholes de cuatro carbonos, o menos,
empleando cualquier reactivo inorgánico necesario:
(a) isobutiraldehído (i)
m-nitrobenzofenona
(b) fenilacetaldehído (j)
n-propil p-toluil cetona
(c) p-bromobenzaldehído (k)
a-metilbutiraldehído
(d) etil metil cetona (l)
n-butil isobutil cetona
(e)
2,4-dinitrobenzaldehído (m)
p-nitroacetofenona
(f) p-nitrobenzofenona (n) 3-nitro-4’-metilbenzofenona
(g) 2-metil-3-pentanona (o)
p-nitropropiofenona
(h) bencil metil cetona
9. Desarrolle todos los
pasos para una posible síntesis de laboratorio de cada uno de los siguientes compuestos,
desde benceno, tolueno y alcoholes de cuatro carbonos o menos, empleando
cualquier reactivo inorgánico necesario:
(a) n-butilbenceno (e)
ácido p-nitro-a-hidroxifenilacético
(b) ácido
a-hidroxi-n-valeriánico (f)
1,2-difenil-2-propanol
(c) 2-metilheptano (g)
1-p-bromofenil-1-fenil-1-propanol
(d)
2,3,5-trimetil-3-hexanol (h)
ácido 3-metil-2-butenoico
10. (a) ¿Qué son A, B y
C?
C6H5C(CH3)2CH2COOH + PCI3 ® A (C11H13OCI)
A + AICI3/CS2 ® B (C11H12O)
B + N2H4,
OH, calor, disolvente de alto p.e. ® C (C11H14)
C dio el espectro RMN
siguiente:
a singulete, & 1.22, 6H
b triplete, & 1.85, 2H, J=7Hz
c triplete, & 2.83, 2H, J=7Hz
d singulete, & 7.02, 4H
(b) También se formó C
por tratamiento del alcohol D (C11H16O) con ácido
sulfúrico concentrado. ¿Cuál es la estructura de D?
11. Dé las fórmulas
estereoquímicas para los compuestos E-J.
R-(+)-gliceraldehído (CH2OHCHOHCHO) + CN-, H+ ® E + F
(tanto E como F tienen la fórmula C4H7O3N)
E + F + OH-, H2O, calor; luego H+ ® G + H (ambos C4H8O5)
G + HNO3 ® I (C4H6O4),
ópticamente activo
H + HNO3 ® J (C4H6O4),
ópticamente. Inactivo
12. (a) En presencia de
HCI seco, el cis-1,2-ciclopentanodiol reacciona con acetona para dar un
compuesto K, C8H14O2, resistente al álcali
hirviente, pero que se convierte rápidamente en los materiales originales con
ácidos acuosos. ¿Cuál es la estructura más probable de K? ¿A qué clase de
compuestos pertenece?
(b) El
trans-1,2-ciclopentanodiol no forma un compuesto análogo. ¿Cómo se explica este
hecho?
13. El intercambio de
oxígeno descrito en el problema 21.9 (Sec. 21.13) puede realizarse utilizando
ion hidróxido como catalizador, en vez de ion hidrógeno. Sugiera un mecanismo
detallado para el intercambio en estas condiciones. (Indicación: Véase Sec.
21.14.)
14. Los vinil alquil
éteres, RCH=CHOR’, son hidrolizados muy rápidamente por ácidos acuosos
diluidos, para formar el alcohol R’OH y el aldehído RCH2CHO. La
hidrólisis en H2 18O da el alcohol R’OH, que sólo contiene
oxígeno ordinario. Describa todos los pasos del mecanismo más probable para la
hidrólisis. Indíquese cómo este mecanismo no sólo explica el experimento con el
trazador, sino también la enorme facilidad con que se realiza la hidrólisis.
15. Ciertos diarilmetanoles
(I) se convierten en una mezcla a partes iguales de bromuro de arilo (II) y
aldehído (III), al ser tratados con bromo.

Aunque G sea -NO2,
-H, -Br o -CH3, el bromo sólo aparece en el anillo con el grupo -OCH3.
La velocidad de la reacción se ve moderadamente afectada por la naturaleza de
G, siendo decreciente según la serie; G=-CH3 > -Br > -NO2. También se hace más lenta en presencia de ion bromuro
adicional.
Indique todos los pasos del
mecanismo más probable para esta reacción. Explique cómo su mecanismo justifica
todos los hechos descritos.
16. Un estudiante algo
ingenuo necesitaba cierta cantidad de becidrol, (C6H5)2CHOH,
y decidió prepararlo por medio de la
reacción entre bromuro de fenilmagnesio y benzaldehído. Sintetizó un mol del
reactivo de Grignard y, para asegurarse un buen rendimiento, agregó a éste dos
moles de aldehído, en vez de uno solo. Al proceder el aislamiento de lo
obtenido, se sintió complacido al observar que había obtenido una buena
cantidad de un producto cristalino; sin embargo, sus esperanzas se
desvasnecieron cuando un examen más detenido la reveló que no había obtenido
bencidrol, sino la cetona benzofenona. Muy perplejo, el estudiante hizo la
primera de muchas visitas al despacho de su profesor.
Volvió avergonzado al
laboratorio y realizó de nuevo la reacción, utilizando cantidades equimolares
de los reactivos, con lo que obtuvo un buen rendimiento del compuesto que
necesitaba.
¿Qué falló en su primer
intento? ¿Cómo le traicionó su generosidad con el benzaldehído? (Indicación:
Vea Sec. 21.14. Examine la estructura del rpoducto de adición inicial.)
(Seguiremos su aventura en Cap. 25, Problema 20.)
17. (a) ¿Cómo se explica
la facilidad con que los éteres tetrahidropiranílicos
(Sec. 12.8) sufren hidrólisis con un
ácido acuoso doluido? (b) Pronostique los productos de dicha hidrólisis para
EtO-THP.
18. (a) Escriba las
fórmulas estructurales de los compuestos L y M, además de los del isoeugenol y
la vanillina.
Eugenol (abajo) + KOH, 225ºC ® isoeugenol (C10H12O2)
isoeugenol
+ (CH3CO)2O
® L (C12H14O3)
(Véase Sec. 24.10)
L + K2Cr2O7, H2SO4,
75ºC ® M (C10H10O4)
M + HSO3-, H2O,
hervir ® vanillina (C8H8O3)
(b) Explique las
conversión de eugenol en isoeugenol.
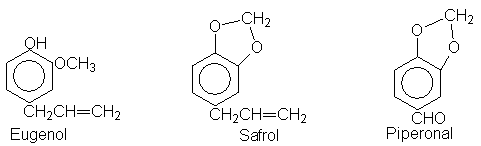
(c) Sugiera un modo de
convertir safrol en piperonal (arriba).
19. Sugiera un mecanismo
para la reacción siguiente:
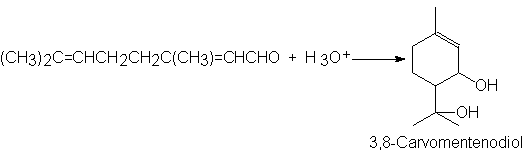
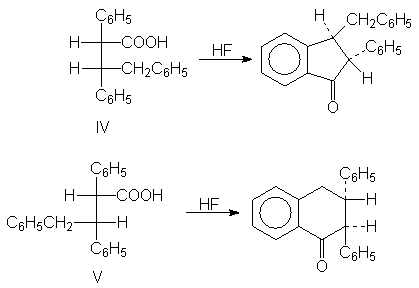
La etapa del cierre del
anillo puede considerarse adición nucleofilica o electrofilica, dependiendo del
punto de vista que se adopte. Indique si esto puede ser así, e identifique el
electrófilo y el nucleófilo.
20. El trímero del
tricloroacetaldehído (compárelo con el paraldehído, Sec. 21.3) existe en dos
formas, N y O, que presentan las características RMN siguientes:
N: singulete, & 4.28
O: dos singuletes, &
4.63 y & 5.50, área de señales en razón 2:1.
Indique las estructuras
de cada uno de estos compuestos con el máximo detalle posible.
21. ¿Cómo se explica la
diferencia de comportamiento entre los diastereómeros IV y V? (Indicación:
Dibuje proyecciones de Newman. ¿Cuáles son los grupos más voluminosos?)
22. El acetal (VI) del glicerol con benzaldehído existe en
dos configuraciones. (a) Dibújelas. (b) Una de ellas existe preferentemente en
una conformación con el grupo fenilo en forma axial.
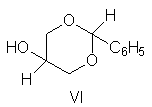
¿Qué configuración es
ésta, y qué contrarresta al factor estérico desfavorable?
23. Describa ensayos
químicos sencillos que permitan distinguir entre:
(a) n-valeraldehído y
dietil cetona (g) dietil
acetal y di-n-propil éter
(b) fenilacetaldehído y
alcohol bencílico (h) metil m-toluil
cetona y propiofenona
(c) ciclohexanona y
ciclohexil metil éter (i)
2-pentanona y 2-pentanol
(d) 2-pentanona y
3-pentanona (j)
paraldehído y isobutil éter
(e) propionaldehído y
dietil éter (k)
dioxano y trioxano
(f) dietil acetal y
n-valeraldehído
Indíquese de forma
explícita lo que haría y observaría.
24. Se cree que un
compuesto desconocido y puede ser alguno de los presentados a continuación;
todos ellos hierven a
temperaturas que sólo difieren en unos pocos grados entre sí. Describa cómo
procedería para saber a cuál de las posibilidades realmente corresponde la
sustancia desconocida. Use ensayos químicos sencillos donde sea posible; donde
sea necesario, emplee métodos químicos más elaborados, como hidrogenación
cuantitativa, degradaciones, equivalentes de neutralización y saponificación,
etc. Utilice cualquier tabla de constantes fisicas que considere de utilidad.
(a) fenilacetaldehído (c)
isoforona (3,5,5-trimetil-2-ciclohexen-1-ona)
m-tolualdehído n-dodecano
o-tolualdehído bencil n-butil éter
acetofenona alcohol n-nonílico
p-tolualdehído
(b) metil B-feniletil
cetona (d)
p-cloroacetofenona
ciclohexilbenceno o-clorobenzoato de metilo
n-butirato de bencilo cloruro de p-clorobencilo
alcohol y-fenilpropílico m-cloronitrobenceno
25. El citral, C10H16O,
es un terpeno que constituye la mayor parte del aceite de lemongrás. Reacciona
con hidroxilamina para dar un compuesto de fórmula C10H17ON,
y con el reactivo de Tollens para dar un
espejo de plata y un compuesto de fórmula C10H16O2.
Por oxidación vigorosa, el citral genera acetona, ácido oxálico (HOOC-COOH) y ácido
levulínico (CH3COCH2CH2COOH)..
(a) Proponga una
estructura para el citral que concuerde con estos datos y con la regla
isoprénica (Sec. 10.31).
(b) De hecho, parece ser
que el citral tiene dos isómeros, el citral a (geranial) y el citral b (neral),
que dan los mismos productos de oxidación. ¿Cuál es la diferencia estructural
más probable entre los dos isómeros?
(c) Por oxidación suave
del geraniol (Cap. 18, Problema 23) se obtiene citral a; del nerol, se obtiene
de forma análoga, citral b. Basándose en esto asigne estructuras a los citrales
a y b.
26. La
(+)-carvotanacetona, C10H16O, es un terpeno que se
encuentra en el aceite de tuya. Reacciona con hidroxilamina y semicarbazida
para dar derivados cristalinos. La prieba de Tollens es negativa, pero decolora
ràpidamente al KMnO4 diluido y frío.
La carvotanacetona puede
reducirse sucesivamente a carvomentona, C10H18O, y a
carvomentol, C10H20O. La carvomentol no reacciona con
ninguno de esos dos reactivos, pero da un resultado positivo con CrO3/H2SO4.
Un grupo de
investigadores encontró que la oxidación de la carvotanacetona dio ácido
isopropilsuccínico y ácido pirúvico, CH3COCOOH; otro grupo aisló
ácido acético y ácido B-isopropilglutárico.
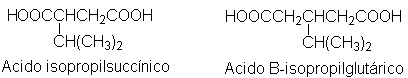
¿Qué estructura única para
la carvotanacetona concuerda con todos estos datos?
27. ¿Cuál de los
siguientes compuestos puede dar origen a cada uno de los espectros infrarrojos
ilustrados en la figura 21.4?
isobutiraldehído etil vinil
éter
2-butanona ciclopropilmetanol
tetrahidrofurano 3-buten-2-ol
28. Dé una estructura o
estructuras que concuerden con cada uno de los espectros RMC de la figura 21.5.
29. Dé una estructura o
estructuras que concuerden con cada uno de los espectros RMN protónica de la
figura 21.6.
30. Escriba las
estructuras de los compuestos P, Q y R basándose en sus espectros infrarrojos
(Fig. 21.7) y RMN (Fig. 21.8).
31. Dé la estructura del
compuesto S basándose en sus espectros infrarrojo, RMC y RMN protónica (Fig.
21-9).