Página
principal http://organica1.org
7 Reacciones.
Adición nucleofílica
El grupo carbonilo, C=O,
rige la química
de aldehídos y
cetonas de dos maneras:
(a) proporcionando
un sitio para
la adición nucleofílica, y
(b)
aumentado la acidez
de los átomos
de hidrógeno unidos
al carbono alfa.
Estos dos efectos
concuerdan con la
estructura del grupo
carbonilo y se deben,
de hecho, a
lo mismo: la
capacidad del oxígeno
para acomodar una
carga negativa.
En esta
sección examinaremos el
grupo carbonilo como
lugar para la
adición nucleofílica.
El carbonilo
contiene un doble
enlace carbono-oxígeno. Como
los electrones n móviles
son fuertemente atraídos
por el oxígeno,
el carbono carbonílico
es deficiente en
electrones, mientras que el oxígeno
es rico en ellos.
Por ser plano, la
parte de la
molécula que lo
contiene queda abierta
al ataque relativamente
libre por arriba
y por abajo,
en dirección perpendicular
al plano del
grupo, por lo que
no es
de sorprender que
este accesible grupo
polarizado sea muy
reactivo.
¿Qué tipo
de reactivo ataca
a un grupo
así? Dado que
el paso importante
de estas reacciones es
la formación de
un enlace con
el carbono carbonílico
deficiente en electrones
(electrofílico), este grupo
es más suceptible
al ataque por
reactivos nucleofílicos ricos
en electrones; esto
es, por bases.
La reacción típica
de aldehídos y
cetonas es la adición
nucleofílica.
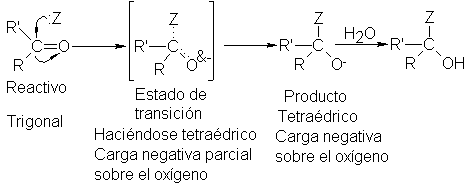
Como es
de suponer, puede
obtenerse una descripción
mucho más realista
de la reactividad del grupo
carbonilo estudiando el
estado de transición para el
ataque de un
nucleófilo. En el
reactivo, el carbono
es trigonal; en
el estado de
transición, el carbono
comienza a adquirir
la configuración tetraédrica
que tendrá en el
producto: los grupos
unidos a él
se acercan entre
sí. Es de
suponer que habrá
un impedimento estérico
moderado en esta
reacción; es decir,
grupos más grandes
(R y R’) tenderán a
resistir más la
aglomeración entre ellos
que los más pequeños.
Sin embargo, el
estado de transición
es relativamente holgado
si lo comparamos,
por ejemplo, con el estado
de transición para
una reacción SN2 con
su carbono pentavalente
a la que
nos referimos cuando
decimos que el
grupo carbonilo es
accesible al ataque.
En el
estado de transición, el
oxígeno comienza
a adquirir los
electrones y la carga
negativa que tendrá
en el producto.
La tendencia del
oxígeno a adquirir
electrones su capacidad
para soportar una
carga negativa es
la verdadera causa
de la reactividad
del grupo carbonilo
ante los nucleófilos.
(La polaridad del
carbonilo no es la
causa de la reactividad,
sino tan sólo
otra manifestación de
la electronegatividad del
oxígeno.)
Por lo
general, los aldehídos
sufren la adición
nucleofílica con mayor
facilidad que las
cetonas. Esta diferencia de
reactividad concuerda con
los estados de
transición implicados y parece
deberse a una
combinación de factores
electrónicos y estéricos.
Donde el aldehído
tiene un hidrógeno,
una cetona tiene
un segundo grupo
alquilo o arilo, que
es más grande
que el hidrógeno,
del primero, y resiste
más a la
aglomeración en el
estado de transición. Un
grupo alquilo libera
electrones, por lo
que debilita el
estado de transición
al intensificar la
carga negativa que
se desarrolla en
el oxígeno.
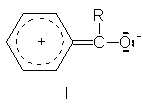
Podríamos suponer
que un grupo
arilo, con su
efecto inductivo de
atracción electrónica , estabiliza
el estado de transición
y acelera la
reacción. Sin embargo,
parece estabilizar aún
más al reactivo,
por resonancia (contribución de I),
causando así una
desactivación neta.
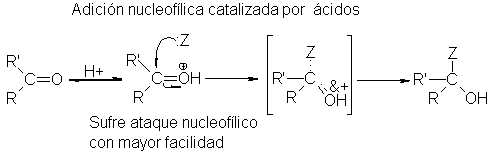
En
presencia de un ácido, un
protón se une al
oxígeno carbonílico. Esta
protonación previa rebaja
la Eact para
el ataque nucleofílico,
pues permite que
el oxígeno adquiera
los electrones n sin
tener que aceptar una
carga negativa; por
esta razón, la
adición nucleofílica a
aldehídos y cetonas
puede ser catalizada
por ácidos (a veces
por ácidos de
Lewis).
9.
Adición de carbaniones.
(a) Condensación aldólica. .
(b) Reacciones relacionadas con
la condesación aldólica.
.
(c) Reacción de
Wittig. .