Página
principal http://organica1.org
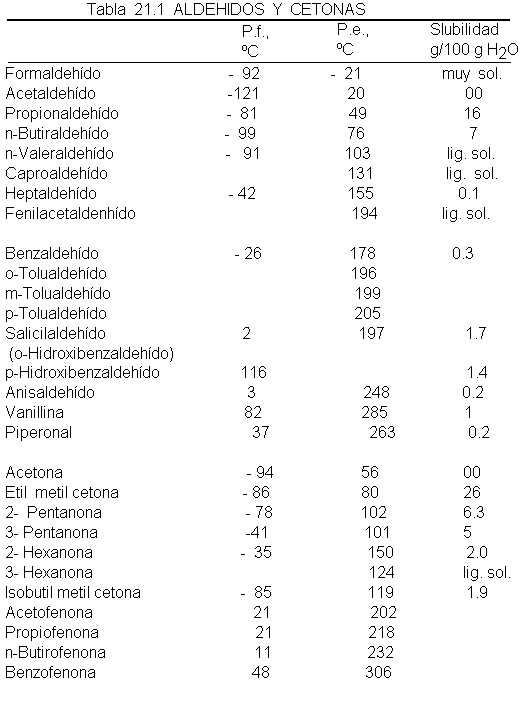
3 Propiedades
físicas
El grupo
carbonílico polarizado convierte
a aldehídos y
cetonas en sustancias
polares, por lo
que tiene puntos
de ebullición más
elevados que los
compuestos no polares
de peso molecular
comparable. Por sí
mismas, no son
capaces de unirse
intermolecularmente por puentes
de hidrógeno, debido
a que sólo
poseen hidrógeno unido
a carbono. Como
consecuencia de lo
anterior, sus puntos
de ebullición son
inferiores a los de
alcoholes y
ácidos carboxílicos comparables.
Así, por ejemplo,
comparemos el n-butiraldehído (p.e. 76ºC)
y la etil
metil cetona (p.e. 80ºC)
con el n-pentano
(p.e. 36ºC) y
el éter etílico
(p.e. 35ºC) pr un
lado, y con alcohol
n-butílico (p.e. 118ºC)
y ácido propiónico (p.e. 141ºC),
por el otro.
Los aldehídos
y las cetonas
inferiores son solubles
en agua, probablemente por
los puentes de
hidrógeno que pueden
establecerse entre las
moléculas de disolvente
y las de
soluto. La solubilidad
límite se alcanza alrededor
de unos cinco
carbonos. Los aldehídos
y cetonas son
solubles en los
disolventes orgánicos usuales.
El formaldehído
es un gas
(p.e. –21ºC), por
este motivo se
utiliza como solución
acuosa (Formalina), en
forma de uno
de sus polímeros
sólidos: paraformaldehído, (CH2O)m,
o trioxano, (CH2O)3.
Cuando se necesita
formaldehído seco (por
ejemplo, para una
reacción de un
reactivo de Grignard),
se obtiene calentado
paraformaldehído o trioxano.
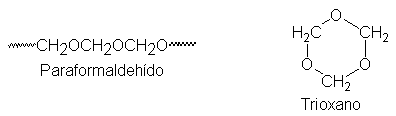
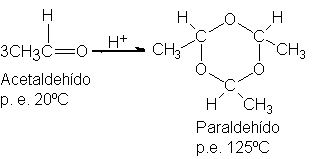
A menudo
se genera acetaldehído
(p.e. 20ºC) a partir
de su trímero
de punto de
ebullición más elevado
calentándolo con ácido: