Página
principal http://organica1.org
13 Adición
de acoholes. Formación
de acetales
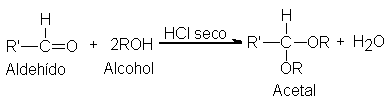
Los alcoholes
se adicionan al
grupo carbonílico de
aldehídos en presencia
de ácidos anhidros
para generar acetales:
La reacción
se realiza abandonado
el aldehído con
un exceso de
alcohol y un
poco de ácido,
ambos anhidros; por lo general,
el ácido es
cloruro de hidrógeno.
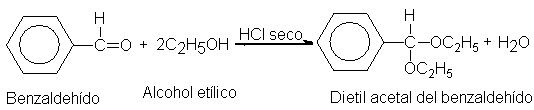
En la preparación
de los etil
acetales el agua
formada se suele
eliminar mediante un
azeótropo de agua
benceno y alcohol
etílico. (Los cetales
simples generalmente son
difíciles de preparar
por reacción entre
cetonas y alcoholes,
y se obtienen
de otras maneras.)
Hay bastante
evidencia de que en solución
alcohólica el aldehído
se encuentra en
equilibrio con un
compuesto llamado hemiacetal:
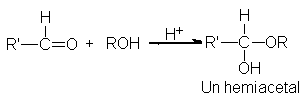
El hemiacetal
se forma por
adición de la
molécula nucleofílica del
alcohol al carbonilo;
es tanto éter como
alcohol. Salvo pocas
excepciones, los hemiacetales
son demasiado inestables
para poderlos aislar.
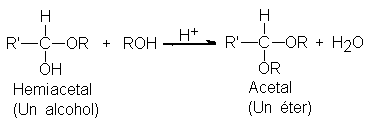 En presencia de
ácido, el hemiacetal,
que actúa como
un alcohol, reacciona
con más disolvente
y forma el
acetal, que es
un éter:
En presencia de
ácido, el hemiacetal,
que actúa como
un alcohol, reacciona
con más disolvente
y forma el
acetal, que es
un éter:
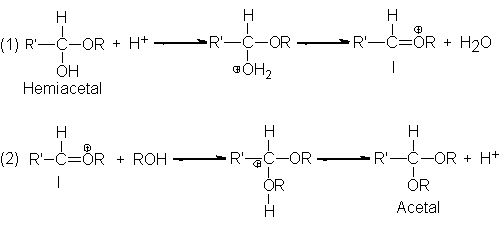 La reacción comprende
la generación del ion I
(paso 1), que luego
se combina con
una molécula de
alcohol (paso 2)
para dar el
acetal protonado. Podemos
apreciar que este
mecanismo es estrictamente
similar al de
la vía SN1,
ya tratada en
la formación de
éteres.
La reacción comprende
la generación del ion I
(paso 1), que luego
se combina con
una molécula de
alcohol (paso 2)
para dar el
acetal protonado. Podemos
apreciar que este
mecanismo es estrictamente
similar al de
la vía SN1,
ya tratada en
la formación de
éteres.
De este
modo, la formación
de acetales comprende
(a) la adición
nucleofílica al grupo
carbonilo y (b) la formación
de un éter
por un carbocatión.
Los acetales
tienen la estructura
de los éteres,
y como tales pueden degradarse
con ácidos, pero
son estables frente
a las bases.
Sin embargo, dfieren
de los éteres
por a gran
facilidad con que
experimentan la escisión
por ácidos: se
convierte en adehído
y alcohol al
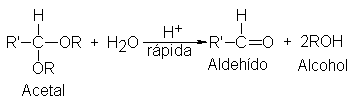
Ser expuesto
a la acción
de ácidos minerales
diluidos, incluso a
temperatura ambiente. El
mecanismo de la
hidrólisis es exactamente
el contrario del
que da los
acetales.
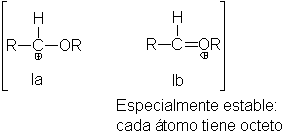
El centro
de la química
de los acetales
es el carbocatión,
que es un
híbrido de las
estructuras 1a y
1b. La contribución
de 1b, donde
cada átomo tiene
un octeto electrónico,
hace que este
ion sea bastante
más estable que
los carbocationes ordinarios.
(De hecho, puede
ser que 1b
por sí solo
represente al ión,
en cuyo caso
será un carbocatión,
sino un ion
oxonio.)
La generación
de este catión
es el paso
que determina la
velocidad, tanto para
la formación de
os acetales (
si se lee la
ecuación
1 hacia la
derecha) como para
su hidrólisis (leyendo
la ecuación 2
hacia la izquierda).
El mismo factor
que estabiliza al
ión, la provisión
de electrones por
el oxígeno, también
lo hace con
el estado de
transición que lleva
a su generación, por lo
que se acelera
la aparición del
ión junto con
todo el proceso;
es decir, la
formación o la
hidrólisis del acetal.
Curiosamente, en
este caso el
oxígeno es la causa
de la activación
en la sustitución
nucleofílica, al igual
que lo es
en la sustitución
electrofílica de éteres
aromáticos. La característica común
es, por supuesto,
el desarrollo de una carga
positiva en el
estado de transición
de la etapa
que determina la
velocidad.
Descubriremos más
adelante que la
química de hemiacetales
y acetales es
fundamental para el
estudio de los
carbohidratos .