Página principal http://organica1.org
7Síntesis de alcoholes
Partiremos de
una visión más amplia de
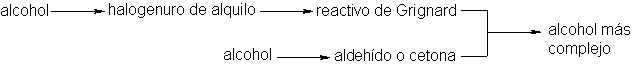
la síntesis de alcoholes complejos. Dijimos que
se suelen preparar
por la síntesis
de reactivos de
Grignard con aldehídos
o cetonas. En este capítulo se vio
que los aldehídos y
las cetonas, además
de los halogenuros
de alquilo a
partir de los
cuales se obtienen los
reactivos de Grignard,
se preparan frecuentemente con alcoholes. Asimismo,
sabemos que los alcoholes simples se
encuentran entre los
productos de más fácil disponibilidad. Por consiguiente, tenemos
a mano una vía de
síntesis qeu nos leva
de los alcoholes sencillos a
los más complicados.
Como
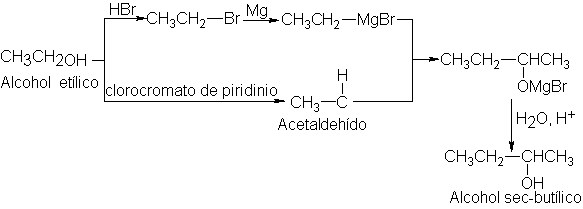
ejemplo sencillo, consideremos la conversión
del alcohol etílico de
dos carbonos en el
alcohol sec-butílico de cuatro:
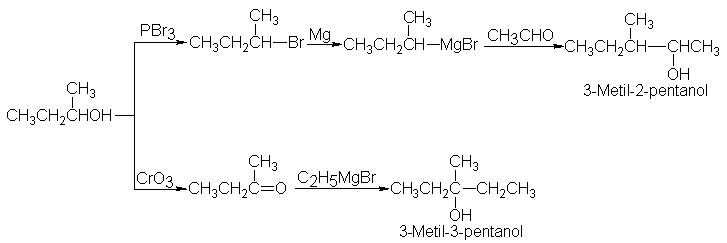
Con el alcohol
sec- butílico así
obtenido, podríamos preparar
alcoholes aún más
grandes:
Combinando lo
estudiado sobre alcoholes con lo
que sabemos sobre los
alquilbencenos y la sustitución aromática,
podemos ampliar la
síntesis para incluir
alcoholes aromáticos. Comenzando
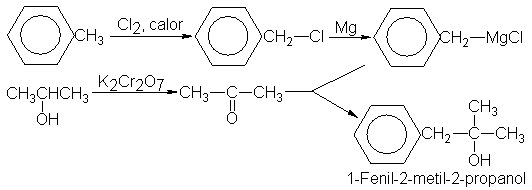
con el benceno, por
ejemplo, podemos obtener 1-feniletanol,
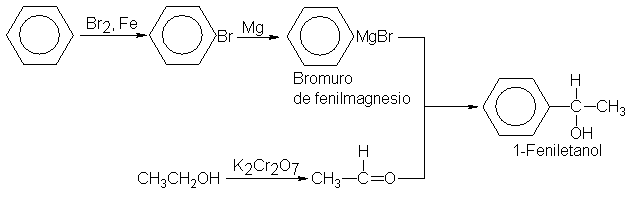
Y comenzando
con tolueno,
1-fenil-2-metil-2-propanol.
Dando por supuesto
que conocemos la química de los pasos individuales, ¿cómo procederemos para
planificar una vía
hacia estos alcoholes
más complejos? En
casi toda síntesis
orgánica lo mejor es
trabajar hacia atrás,
desde el compuesto deseado.
Hay relativamente pocos caminos
para preparar un
alcohol complejo; también
hay pocos caminos para
lograr el reactivo
de Grignard, el aldehído o la cetona,
y así sucesivamente hasta legar
a las materias
primas requeridas. Por otra
parte, son tantas
las reacciones diferentes
que sufren un alcohol
que, si comenzamos al revez, encontraremos un número desconcertante de
posibilidades, de las que
sólo unas pocas
nos levarían a la meta deseada.
Supóngase que
disponemos de todos los
alcoholes de cuatro cabonos
o menos (lo cual
es bastante razonable)
y que nos
interesa, por ejemplo,
obtener 2-metil-2-hexanol.
Escribamos la estructura
de esta molécula objetivo
y veamos qué
se necesita para sintetizarla.
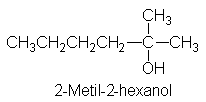
Puesto
que es
un alcohol terciario,
debemos usar un
reactivo de Grignard y
una cetona. Pero,
¿cuál es el
reactivo de Grignard?
¿Cuál es la
cetona? Empleando la
metodología anterior, observamos que hay
dos posibilidades:
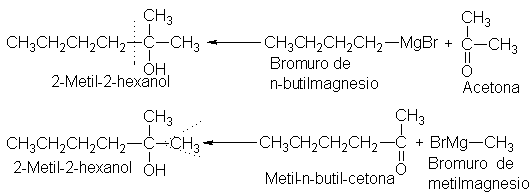
De estas
dos posibilidades, debemos
escoger la que
emplea el reactivo
de Grignard de cuatro
carbonos y la cetona
de tres; ahora bien,
¿cómo se preparan estos
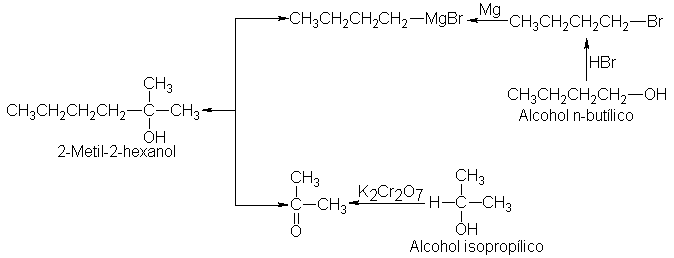
compuestos? El reactivo de
Grignard sólo se
puede obtener a
partir del correspondiente halogenuro de
alquilo, el bromuro
de n-butilo, que a
su vez,
seguramente se prepara
a partir de
un alcohol, el
n-butílico. La cetona
requiere, claro está,
alcohol isopropílico. Al reunir
ahora la síntesis completa
obtenemos la secuencia
siguiente:
Consideremos que,
además de los alcoholes de
cuatro o menos carbonos, disponemos benceno y tolueno, otra
suposición razonable, y queremos
obtener
1-fenil-3-metil-2-butanol. De
nuevo, escribimos la estructura del
alcohol y trabajamos hacia
atrás hasta legar
a las materias
primas iniciales. Para hacer un
alcohol secundario, utilizamos
un reactivo de
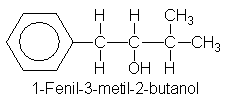
Grignard
y un
aldehído y, como es usual,
hay dos alternativas:
podemos suponer que
la molécula se
forma al juntar
(a) C-1 y C-2)
o (b) C-2 y C-3. De las
dos posibilidades seleccionamos
la primera puesto que requiere
un compuesto que tiene solamente
un carbono
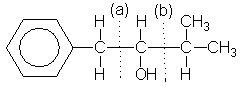
Unido al
anillo bencénico, que está
disponible en el tolueno.
Por consiguiente, necesitarmeos
un aldehído con cuatro
carbonos y cloruros
de bencilmagnesio. El aldehído
puede obtenerse a partir
de alcohol isobutílico, mientras que el cloruro
de bencilmagnesio se
obtiene del cloruro de
bencilo, que, a su
vez, se obtiene de
la cloración del
tolueno por radicales
libres.
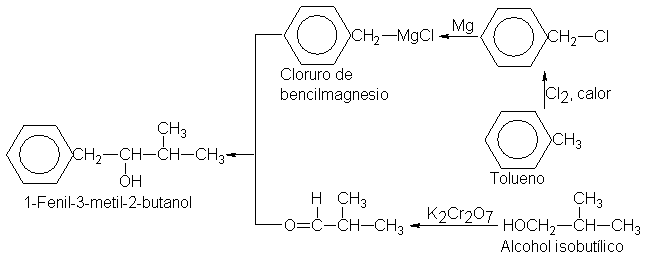 La síntesis está completa:
La síntesis está completa:
Nuestra síntesis
básica se puede variar
aún más. Al
igual que sus
contrapartes alquílicas y
arílicas, tanto los
acetiluros de litio
como los reactivos
de alquinil Grignard
se pueden añadir
a aldehídos y
cetonas para formar alcoholes.
Por ejemplo:
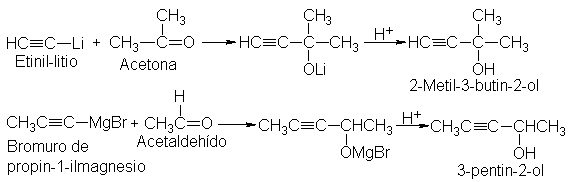
Hemos formado
así compuestos que no sólo
contienen -OH, sino
también un segundo grupo muy
reactivo, el triple
enlace carbono-carbono. Como
ya hemos visto,
el triple enlace
puede convertirse, con
un alto grado
de estereoselectividad, en un
doble enlace, sobre el cual
pueden ocurrir varias reacciones de
adición, también muy
estereoselectivas, para producir una
gran variedad de
productos, cada uno
de los cuales
también contiene el
grupo -OH.
Ahora
que sabemos cómo
obtener alcoholes complejos
desde los simples, ¿Qué
podemos hacer con ellos?