Página
principal http://organica1.org
6 Oxidación
de alcoholes
La
oxidación de un alcohol implica la
pérdida de uno
o más hidrógeno
(hidrógenos a)
del carbono que
tiene el grupo
-OH. El tipo
de producto que se
genera depende del
número de estos
hidrógenos a que
tiene el alcohol,
es decir, si es
primario secundario o
terciario.
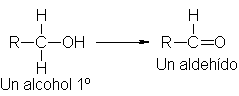
Un alcohol
primario contiene dos
hidrogenos a, de modo que puede
perder uno de
ellos para dar
un aldehído,
ambos, para formar un ácido carboxílico.
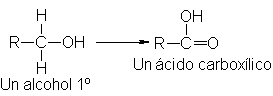
(En
condiciones apropiadas, veremos que el propio
aldehído puede oxidarse a
ácido carboxílico.)
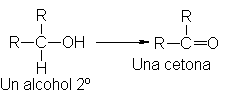
Un
alcohol secundario puede
perder su único hidrógeno a para transformarse en una
cetona.
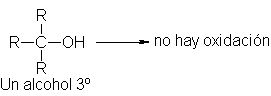
Un alcohol
terciario no tiene
hidrógeno a, de modo que
no es oxidado.
(No obstante, un agente
ácido puede deshidratarlo
a un alqueno
y oxidar luego
éste.)
Ya
hemos explicado estos productos de oxidación
aldehídos, cetonas y ácidos
carboxílicos -, y
debemos reconocerlos por
sus estructuras, auqnue aún no hayamos
tratado gran parte
de su química. Son compuestos importantes, y su
preparación por la oxidación de alcoholes es
de gran valor
en la síntesis
orgánica.
El
número de agentes oxidantes
disponible para el químico
orgánico está creciendo con
enorme rapidez. Al igual que con todos
los métodos sintéticos,
el interés se centra en el
desarrollo de reactivos
altamente selectivos que operen
sólo sobre un grupo
funcional de una molécula
compleja, sin afectar a otros grupos funcionales que pudieran estar presentes.De
los numerosos reactivos que
se pueden utilizar
para oxidar alcoholes,
sólo podemos considerar
los más comunes,
aquellos qeu contienen
Mn (VI) o Cr (VI). En
la sección 8.22 hemos
estudiado el manganeso
heptavalente en la forma
de permanganato de potasio,
KMNO4. También se utiliza
mucho el cromo hexavalente, en
particular el a´cido crómico,
en alguna forma elegida
para la tarea que
se desea desarrollar:
ácido acuoso K2Cr2O7,
CrO3 en ácido
acético glacial, CrO3
en piridina, etc.
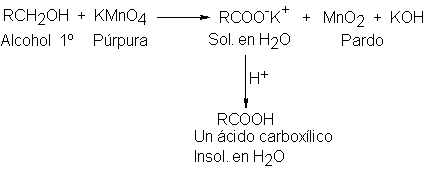
La
oxidación de alcoholes primarios
a ácidos carboxílicos
se suelen realizar
empleando permanganato de potasio. Se obtienen mejores rendimientos si se
juntan el permanganato
y el alcohol
en un disolvente no polar
utilizando la catálisis
de transferencia de fase.
Cuando se completa la reacción,
se filtra una solución
acuosa de la
sal potásica soluble
del ácido carboxílico para
separarla del MNO2, y el
ácido se libera por
adición de un
ácido mineral más fuerte.
La oxidación
de alcoholes a
la etapa de aldehído
o cetona se
logra utilizando Cr(VI) en una de las formas descritas antes.
La oxidación de
alcoholes secundarios a cetonas
suele ser sencilla.
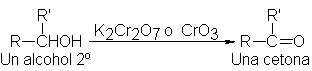
Dado que los aldehídos son
susceptibles de mayor oxidación,
la conversión de un alcohol
primario en aldehído puede
ser complicada. Uno de
los mejores y más
convenientes reactivos para este
propósito es el clorocromato
de piridonio (C5H5NH+CrO3C-), que
se obtiene por reación entre
ácido crómico y
cloruro de piridino.
![]()
En
relación con su análisis, estudiaremos dos
reactivos que se utilizan para
oxidar alcoholes de
tipos especiales: (a)
los hipohalogenitos y (b) el ácido peryódico