Página principal http://organica1.org
3
Ruptura del enlace C---OH
Hemos
estudiado dos reacciones
importantes de los
alcoholes: su reaccción
con halogenuros de hidrógeno
para formar halogenuros
de alquilo,
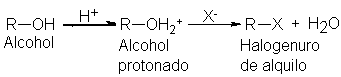
Y su
deshidratación para obtener alquenos.
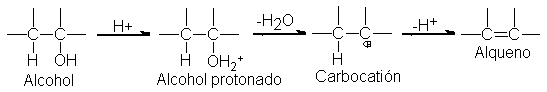
Estos son,
por supuesto, ejemplos de los dos
tipos más importantes
de reacción que hemos
visto hasta el momento: la sustitución nucleofílica
y la eliminación.
Cada una de
estas reacciones requiere la presencia
de ácido para convertir el alcohol
en el verdadero sustrato, el alcohol protonado. Tanto si se
trata de una reacción de sustitución de eliminación, como si sigue
un mecanismo bi o unimolecular, el enlace carbono-oxígeno sufre
una ruptura heterolítica el
sustrato debe perder
un grupo saliente-. El alcohol
protonado pierde con facilidad la molécula débilmente básica que es
el agua, mientras que el alcohol
no protonado debería
deshacerse del fuertemente
básico ion hidróxido, que representa
un proceso tan difícil
que raras veces sucede, o quizá nunca.
Los
alcoholes son los precursores de una
amplia variedad de compuestos
que pierden el
grupo –OH, que es
reemplazado por algún
otro grupo o
es eliminado con
la formación de un doble
enlace. Sin embargo, esta pérdida
de -OH no se
realiza directamente, en una sola
etapa, a partir
del propio alcohol:
se efectúa indirectamente,
convirtiendo el alcohol
en alguna otra
cosa; el grupo
saliente, muy pobre,
debe convertirse en
uno bueno. El
modo más sencillo de lograrlo
es mediante básico neutralizará rápidamente
al ácido. Si está presente
sólo un nucleófilo o una
base débiles, la
reacción tiende a seguir un mecanismo unimolecular,
por la vía de carbocationes, con la
probabilidad de alguna transposición. Como se
verá en la
sección 18.5, hay
otro camino para convertir el –OH
en un buen grupo
saliente: es más
elaborado que la protonación, pero presenta
ciertas ventajas importantes.