Página
principal http://organica1.org
9
Oximercuración-desmercuración
En presencia
de agua, los alquenos reaccionan con acetato mercúrico para dar compuestos
hidroximercúricos, que dan alcoholes por reducción.
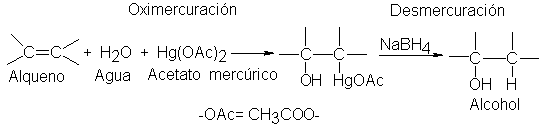
La primera
etapa, la oximercuración, implica la
adición de –OH y –HgOAc al doble enlace carbono-carbono. Luego, en la desmercuración, se reemplaza –HgOAc
por -H. La secuencia de la reacción se
reduce a la hidratación del alqueno, pero es de aplicación mucho más amplia que
la hidratación directa.
El proceso
en dos etapas de la oximercuración-desmercuración es rápido y cómodo, se
realiza en condiciones moderadas y da excelentes rendimientos, a menudo
superiores al 90%. El alqueno a temperatura ambiente se añade a una solución
acuosa de acetato mercúrico diluida con el disolvente tetrahidrofurano. La
reacción se completa, por lo general, en pocos minutos. No se aísla el
compuesto organomercúrico, sino que se reduce in situ con borohidruro de sodio,
NaBH4. (Se recupera el mercurio como una bola de mercurio
elemental.)
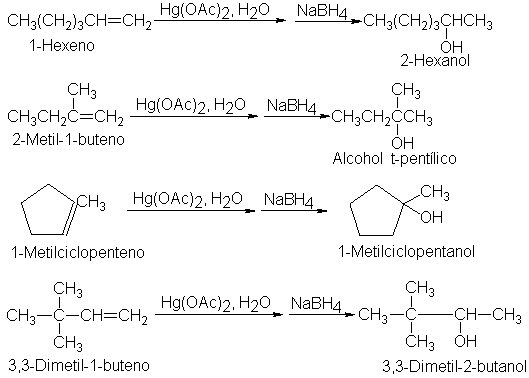
La
oximercuración-desmercuración es
altamente regioselectiva y da alcoholes que corresponden a la adición de
Markovnikov de agua al doble enlace
carbono-carbono. Por ejemplo;
La
oximercuración comprende la adición electrofílica al doble enlace
carbono-carbono, actuando como electrófilo el ion mercúrico. La ausencia de
transposiciones y el alto grado de estereoselectividad (típicamente anti) en el paso de la oximercuración es
un argumento en contra de la formación de un carbocatión abierto como
intermediario. En cambio, se ha propuesto la formación de un ion mercurinio cíclico, análogo a los
iones bromonio y
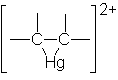
Cloronio,
implicado en la adición de halógenos. En
1971, Olah presentó pruebas
espectroscópicas para la preparación de soluciones estables de tales iones
mercurinio, que desde entonces han sido observados en fase gaseosa.
El ion
mercurinio es atacado por el disolvente nucleofílico agua, en este caso para
dar el producto de adición. Este ataque es por atrás (a menos que sea impedido
por alguna característica estructural), siendo el resultado neto la adición
anti, como en los halógenos. Por
consiguiente, el ataque es del tipo SN2; sin embargo, la orientación
de la adición indica que el nucleófilo se une al carbono más sustituido, como
si hubiera un cabrocatión intermediario libre. Aquí, al igual que con el ion
halogenonio, tenemos un anillo inestable de tres miembros; cuando reacciona, el
estado de transición tiene, evidentemente, mucho cacácter SN1, y la orientación
es controlada por factores polares y no por impedimento estérico.
Aunque no se
comprende realmente la reacción de desmercuración, se han propuesto radicales
libres como intermediarios. Cualqueira que sea el mecanismo, generalmente la
desmercuración es no estereoselectiva, por lo que en ciertos casos especiales
puede ir acompañada de transposiciones.
A pesar de
la estereoselectividad de la primera etapa, por tanto, el proceso total no es
estereoselectivo en general. Puede
haber transposiciones, pero no son comunes. La reacción del
3,3-dimetil-1-buteno ilustra la ausencia de las transposiciones típicas de los
carbocationes intermediarios.
Puede
efectuarse la mercuración en diferentes
disolventes para obtener productos distintos de alcoholes. Este empleo de la solvomercuración como herramienta de
síntesis general se debe en gran parte a H. C. Brown.