Página
principal http://organica1.org
5 Propiedades físicas
Las
propiedades físicas de un alcohol se comprenden mejor si reconocemos este hecho
simple: estructuralmente, el alcohol es un compuesto de un alcano y agua.
Contiene un grupo lipófilo, del tipo de un alcano, y un grupo hidroxilo que es
hidrófilo, similar al agua. De estas dos unidades estructurales, el grupo –OH
da a los alcoholes sus propiedades físicas características, y el alquilo es el
que las modifica, dependiendo de su tamaño y forma.
![]()
El grupo –OH
es muy polar y, lo que es más importante, es capaz de establecer puentes de
hidrógeno: con sus moléculas compañeras, con otras moléculas neutras.
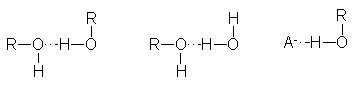
y con aniones. Las propiedades físicas (Tabla 1) muestran
algunos de los efectos de estos puentes
de hidrógeno.
Veamos
primero los puntos de ebullición.
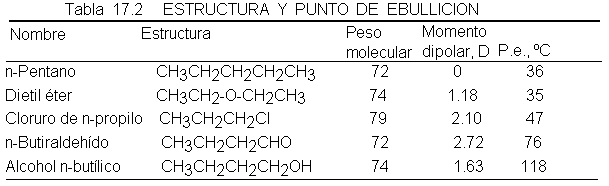
Entre los hidrocarburos, los factores que determinan puntos de ebullición
suelen ser principalmente el peso molecular y la forma, lo que es de esperar de
moléculas que se mantienen unidas esencialmente por fuerzas de Van der Waals.
Los alcoholes también muestran un aumento del punto de ebullición al aumentar
el número de átomos de carbono y una disminución del mismo con la ramificación.
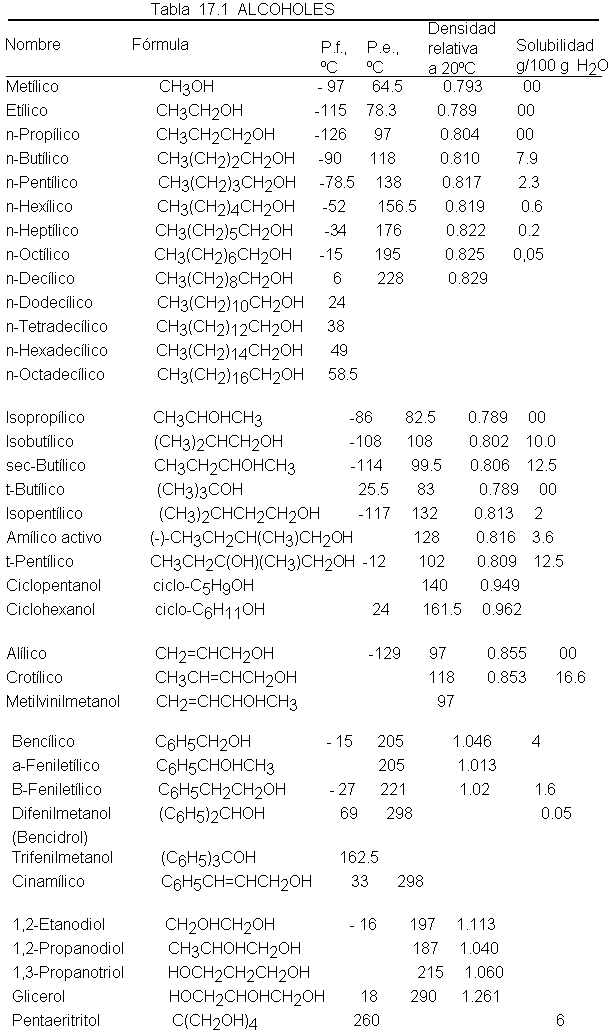
Sin embargo, lo notable es el punto de ebullición tan elevado de los alcoholes, que como se muestran en la tabla 2
son mucho más altos que los de hidrocarburos
del mismo peso molecular e, incluso, más altos que los de muchos otros
compuestos de polaridad considerable. ¿Cómo se justifica esto?
La respuesta
está en que los alcoholes, como el agua, son
líquidos asociados: sus puntos de
ebullición anormalmente elevados se deben a la mayor energía necesaria
para romper los puentes de hidrógeno que mantienen unidas las moléculas. A pesar de que los éteres y aldehídos
contienen oxígeno, sólo tienen hidrógeno enlazado con carbono, por lo que no
son suficientemente positivos como para enlazarse apreciablemente con el
oxígeno.
La espectroscopia infrarroja
ha desempeñado un papel fundamental en el estudio de la asociación por
puentes de hidrógeno. En solución diluida en un disolvente no polar, como
el tetracloruro de carbono (o en
fase gaseosa), en la que la asociación molecular es mínima, el etanol, por
ejemplo, presenta una banda de alargamiento O-H a 3640 cm –1.
A medida que
aumenta la concentración de etanol, esta banda es reemplazada gradualmente por
otra más ancha a 3350 cm –1. La unión del hidrógeno al segundo
oxígeno debilita el enlace O-H, por lo que disminuye la energía y, en
consecuencia, la frecuencia de vibración.
El comportamiento de los alcoholes como solutos también refleja la tendencia a
formar puentes de hidrógeno. En marcado contraste con los hidrocarburos, los alcoholes
inferiores son miscibles con agua. Puesto que las moléculas de los alcoholes se
mantienen unidas por el mismo tipo de fuerzas intermoleculares que las de agua,
puede haber mezclas de las dos clases de moléculas. La energía necesaria para
romper un puente de hidrógeno entre dos moléculas de agua o dos de
alcohol, es proporcionada por la
formación de un puente de hidrógeno entre una molécula de agua y otra de
alcohol.
Sin embargo,
esto es cierto sólo para los alcoholes inferiores, en los que el grupo
hidrófilo-OH constituye una parte considerable de la molécula. A
medida que el grupo lipófilo aumenta el tamaño, disminuye la solubilidad
en agua. Para fines prácticos, consideramos que el límite entre solubilidad e
insolubilidad en agua se encuentra entre los cuatro y cinco átomos de carbono
para alcoholes primarios normales.
Los
alcoholes polihidroxilados proporcionan
más de un lugar por molécula para formar puentes de hidrógeno, lo que se
refelja en sus propiedades. El diol más sencillo, el 1,2-etanodiol
(etilenglicol), hierve a 197ºC. Los glicoles inferiores son miscibles con agua,
y los que tienen hasta siete átomos de carbono presentan una solubilidad
apreciable en ella. (El etilenglicol debe su uso como anticongelante por
ejemplo, Prestone a su elevado punto de ebullición, su bajo punto de
congelación y su alta solubilidad en agua.)
Ya
analizamos el comportamiento de los alcoholes como disolventes. Por medio de sus grupos alquilo lipófilos, pueden
disolver compuestos no ionicos, como sustratos orgánicos. A través de sus grupos -OH pueden disolver compuestos iónicos, comoo
reactivos inorgánicos. Como disolventes próticos
solvatan fuertemente a los aniones, especialmente por medio de puentes de
hidrógeno; solvatan a los cationes a través de los pares electrónicos no
compartidos del oxígeno.
Vimos que,
como disolventes, los alcoholes distan mucho de ser inocentes espectadores.
Su oxígeno es básicos y nucleofílico. En la eliminación del tipo E1, los alcoholes
actúan como base y como disolvente. En la sustitución nucleofílica, los
alcoholes pueden actuar como nucleófilo
en las reacciones SN2 y prestar asistencia ncuelofílica para la
formación de intermediarios catiónicos.