Página principal http://organica1.org
17 Limitaciones
de la síntesis de Grignard.
La misma
reactividad que hace
tan útil al
reactivo de Grignard
limita estrictamente las
posibilidades de su
empleo. Cuando planificamos
als condiciones experimentales de
una síntesis, debemos
tener presente esta
reactividad para seleccionar
el halogenuro que
ha de convertirse en el reactivo de
Grignard, y elegir
el compuesto con el
que ha de
reaccionar.
En
nuestro primer encuentro
con el reactivo de Grignard,
reaccionó con agua para
formar un alcano; el agua, que es
el ácido más fuerte,
desplaza de su
sal al ácido extremadamente débil,
el alcano. Del mismo
modo, todo compuesto que
tiene hidrógeno unido
a un elemento
electronegativo oxígeno, nitrógeno, azufre e, incluso,
carbono con enlace triple es
suficientemente ácido como
para descomponer al
reactivo de Grignard,
que también reacciona
velozmente con oxígeno y
dióxido de carbono,
y con casi todos
los compuestos orgánicos con
enlaces múltiples carbono-oxígeno o
carbono-nitrógeno.
¿Cómo afecta
todo esto a
nuestra reacción entre
un reactivo de Grignard
y un aldehído?
En
primer lugar, el
halogenuro de alquilo,
el aldehído y el éter
empleado como disolvente,
deben ser secados
escrupulosamente y liberados
del alcohol, del
cual probablemente derivan las
materias primas: un
reactivo de Grignard ni
siguiera se formará en presencia de
agua.
Nuestro
equipo debe estar completamente
seco antes de comenzar.
Debemos proteger todo
el sistema del
vapor de agua, oxígeno y dióxido de
carbono atmosféricos: el
primero puede mantenerse
fuera del equipo,
empleando tubos con cloruro de calcio, y los otros
dos pueden sacarse
por arrastre con nitrógeno
seco. Una vez
hecho esto, podemos abrigar
la esperanza de obtener
un buen rendimiento
en producto, siempre
que la elección del
halogenuro y del
aldehído haya sido adecuada.
No podemos preparar un reactivo de
Grignard con un compuesto
(por ejemplo, HOCH2CH2Br) que,
además del halógeno, contenga algún
grupo (por ejemplo,
-OH) que Grignard reaccionaría
con el grupo activo (-OH) de otra
molécula para generar
un producto no
deseado (HOCH2CH2-H).
Debemos ser
particularmente precavidos en la preparación
de un halogenuro
de arilmagnesio, en
vista de la amplia variedad
de sustituyentes que pueden
encontrarse en el anillo bencénico.
Carboxilo (-COOH), hidroxilo (-OH), amino
(-NH2) y -SO3H contienen hidrógeno unido
a un oxígeno o nitrógeno, por lo que
son tan ácidos que
descompondrían un reactivo de
Grignard. Acabamos de
ver que estos
reactivos se adicionan
al grupo carbonilo
(C=O) y, en forma similar, también se
agregan a los grupos
-COOR y -C=N;
en cambio, el
grupo nitro (-NO2), los oxida.
Son relativamente pocos los grupos que
pueden estar presentes en
la molécula de
halogenuro que se
emplea para preparar
un reactivo de
Grignard, entre ellos
están -R, -Ar,
-OR y -CI (de un cloruro de
arilo).
Por
motivos similares, el aldehído
(u otro compuesto)
con que ha de
reaccionar un reactivo
de Grignard no
debe contener otros
grupos sensibles a
él. Por ejmplo,
un reactivo de
Grignard se descompondría
antes de poder añadirse
al grupo carbonilo
de:
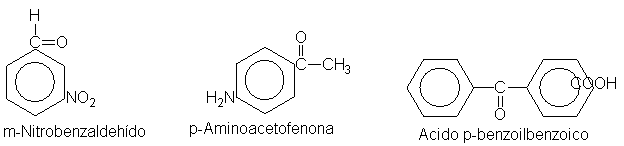
Estas pueden
parecer limitaciones severas,
y lo son.
Sin embargo, es tan
grande el número
de combinaciones aceptables que
el reactivo de
Grignard es una
de nuestras herramientas
de síntesis más
útiles. El tipo
de precauciones descrito aquí
debe ser considerado
en toda clase de síntesis orgánica: no debemos restringir nuestra atención
al grupo que
nos interesa específicamente, sino
que debemos estudiar
la posible interferencia de
otros grupos funcionales.
Aún cuando
veamos la posibilidad
de interferencia, a menudo
podemos hacer algo
positivo, como introducir temporalmente un grupo
protector, para evitar
una reacción no
deseada.