Página
principal http://organica1.org
14
Síntesis de Grignard de los
alcoholes
Recordemos que el
reactivo de Grignard tiene la
fórmula RMgX y que se
prepara por la
reacción entre magnesio
metálico y un halogenuro orgánico apropiado. Este
halogenuro puede ser de alquilo (1º, 2º ó 3º), de alilo, de
aralquilo (por ejemplo, bencilo) o arilo (fenilo o fenilo sustituido). El
halógeno puede ser -CI, -Br o -l. (Los cloruros
de arilmagnesio se deben preparar en el éter cíclico tetrahidrofurano, en
vez de en éter etílico.)
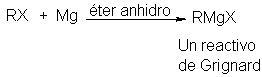
Uno de
los usos
más importantes del
reactivo de Grignard
es su reacción
con aldehídos y cetonas. El
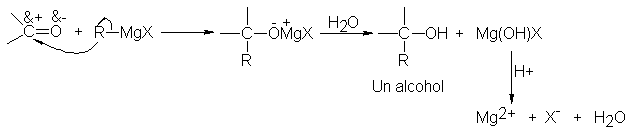
enlace carbono-magnesio del
reactivo de Grignard
es muy polar, siendo
negativo el carbono
en relación con el magnesio electropositivo. Luego, no es de sorprender que en la adición a compuestos carbonílicos, la parte orgánica
se una al
carbono, y el
magnesio, al oxígeno.
El producto es la
sal magnésica del alcohol
débilmente ácido, que es fácilmente
convertible en el alcohol
libre por la
adición de un
ácido más fuerte,
el agua.
Debido a que
el Mg(OH)X así
formado es un
material gelatinoso, dificil
de manejar, se utiliza
a menudo un ácido mineral
diluido (HCI, H2SO4) en vez
de agua, de modo que se formen
sales magnésicas solubles
en ésta..
Los
reactivos de Grignard son los
clásicos para estas
síntesis. No obstante,
se están utilizando
cada vez más los compuestos orgánicos del litio, principalmente porque
son menos propensos a las
reacciones colaterales indeseadas. Los organolitios
pueden ser preparados
de la misma manera que
los reactivos de
Grignard, pro reacción del
metal con halogenuros orgánicos.
Por ser el litio más electropositivo que
el magnesio, son más polares los
enalces carbono-litio que
los carbonos-magnesio; el carbono
es más
negativo más semejante
a un carbanión - y, en general, los
organolitio son algo más
reactivos que los reactivos de
Grignard.
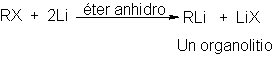
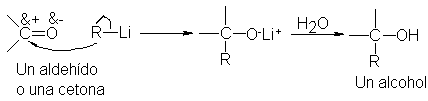
Los
organolitios reaccionan con aldehídos
y cetonas de la misma manera
que hemos indicado
para los reactivos
de Grignard y dan
el mismo tipo
de productos. Consideramos esta
reacción como una
ampliación de la síntesis de Grignard
original. Denominaremos al
método general síntesios
de Grignard de alcoholes, y a menudo
la trataremos en
función de los
reactivos organomagnésicos. Debe
entenderse, sin embargo, que la
mayor parte de lo que se
expone se explica
a la síntesis análoga
con organolitios.
¿Por
qué es
tan importantes la síntesis de Grignard? Porque nos permite
tomar dos moléculas
orgánicas y convertirlas en
una más
grande. Para hacer
esto, formamos
un enalce carbono-carbono. Nuevamente
unimos un carbonoo electrofílico
con uno nucleofílico (Sección 11.13). En esta
ocasión, el grupo carbonilo proporciona
el carbono electrofílico.
Para el carbono nucleofílico volvemos
de nuevo al grupo semejante
a un carbanión de un compuesto organometálico: un reactivo
de Grignard o un organolitio. Por tanto,
la reacción de
Grignard es un
ejemplo de la reacción
característica de aldehídos
y cetonas: la adición
nucleofílica.
Sin
embargo, esto es solamente la mitad de la historia. La síntesis de
Grignard no sólo
involucra la formación de
un enalce carbono-carbono, sino
que el producto contiene un grupo funcional
de gran versatilidad, el grupo
OH. Ahora, como veremos, el
camino está abierto
para otras síntesis y para
la construcción de
estructuras aun más
grandes y complicadas.