Página principal http://organica1.org
13 Aldehídos
y cetonas: introducción
Al estudiar
la química de los halogenuros de alquilo
y alquenos en el capítulo 5, hemos considerado necesario tratar los
alcoholes. De la misma manera, para
analizar la química de los
alcoholes, debemos saber algo de
otra clase de
compuestos: los aldehídos y
las cetonas.
Los
aldehídos y cetonas tienen fórmulas
generales:
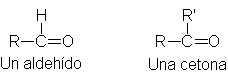
En ambas, el
grupo funcional es el carbonilo -C=O, y, como veremos más adelante, aldehídos
y cetonas se parecen mucho en la mayoría de sus reacciones. Como el doble enlace carbono-carbono, el
grupo carbonilo también es insaturado y también sufre adición. Sin embargo, esta adición difiere en varios aspectos
importantes de la del doble enlace
carbono-carbono.
Aunque los
electrones del doble enlace carbonílico
unen a dos átomos de electronegatividad diferente, no se comparten por igual;
en particular, la nube n móvil
es atraída fuertemente hacia el átomo más electronegativo, el oxígeno. Como resultado, el carbono carbonílico es
deficiente en electrones, y el oxígeno
del grupo es electrónicamente rico.
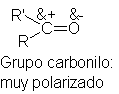
Esta fuerte polarización del grupo carbonilo
tiene dos consecuencias
importantes.
Primero, no
hay duda en cuanto
a la orientación de la adición a este grupo:
cualquiera que sea el
mecanismo involucrado, la
adición de un reactivo
no simétirco se orientada de manera
que la porción nucleofílica (básica) se liga al
carbono, mientras que la parte
electrofílica (ácida) lo
hace al oxígeno.
Segundo, el carbono
carbonílico deficiente en
electrones es especialmente
sensible al ataque
por nucleófilos. En tanto la
adición electrofílica es la
reacción típica de los alquenos,
la
típica de los aldehídos
y las cetonas
es la adición
nucleofílica.
En este
momento trataremos sólo
un ejemplo de tal
adición.