ALCOHOLES
REACCIONES
(Ir a página principal http://organica1.org/ )
1. Partiendo de los
alcoholes pentílicos isómeros del problema 1(a) del capítulo 17, del (a)
indique cuáles (de haberlos) darían una
prueba del yodoformo positiva. (b) Describa cómo respondería cada uno de ellos al reactivo de Lucas. (c) Describa cómo
responderían frente al anhídrido
crómico. (d) Desarrolle todos los pasos de una posible síntesis de cada uno,
partiendo de alcoholes de cuatro carbonos o menos, y empleando los reactivos
inorgánicos necesarios.
2. Dé las estructuras y
los nombres de los principales productos
de la reacción (de haberlos) del
ciclohexanol con:
(a) H2SO4
concentrado, frío (m)
producto (f) + Mg
(b) H2SO4,
calor (n)
producto (m) + producto (d)
(c) KMnO4
frío, diluido (o)
producto (b) + KMnO4 frío, alcal.
(d) CrO3, H2SO4 (p)
producto (b) + Br2/CCI4
(e) Br2/CCI4 (q)
producto (b) +C6H6,
HF
(f) HBr concentrado,
acuoso (r)
producto (b) + H2, Ni
(g) P + I2 (s)
producto (q) + HNO3/H2SO4
(h) Na (t)
producto (b) + N-bromosuccinida
(i) CH3COOH, H+ (u)
producto (b) + CHCI3 + t-BuOK
(j) H2, Ni (v)
producto (d) + C6H5MgBr
(k) CH3MgBr (w)
cloruro de tosilo, OH-
(l) NaOH(ac) (x) producto (w) +
t-BuOK
3. Desarrolle todos los
pasos de una posible síntesis de laboratorio para cada uno de los siguientes
compuestos, desde el alcohol n-butílico, empleando los reactivos inorgánicos
necesarios. Siga las instrucciones generales indicadas en el capítulo 5,
problemas.
(a) bromuro de n-butilo (m)
n-octano
(b) 1-buteno (n)
3-octino
(c) bisulfato de
n-butilo (o)
cis-3-octeno
(d) n-butóxido de
potasio (p)
trans-3-octeno
(e) n-butiraldehído, (q) 4-octanol
CH3CH2CH2CHO (r) 4-octanona
(f) ácido n-butírico, CH3CH2CH2CH2CCH2CH2CH3
(g) n-butano ||
(h) 1,2-dibromobutano O
(i) 1-cloro-2-butanol (s)
5-(n-propil)-5-nonanol
(j) 1-butino (t)
n-butirato de n-butilo,
(k) etilciclopropano CH3CH2CH2C-OCH2CH2CH2CH3
(l)
1,2-butanodiol ||
O
4. Dé las estructuras y
nombres (donde sea posible) de los principales productos orgánicos de las
reacciones siguientes:
(a) alcohol bencílico +
Mg
(b) alcohol isobutílico
+ C6H5COOH + H+
(c) bromuro de etileno +
NaOH(ac), exceso
(d) alcohol n-butílico +
H2, Pt
(e) alcohol crotílico
(CH3CH=CHCH2OH) + Br2/H2O
(f) CH3OH + C2H5MgBr
(g) bromuro de
p-bromobencilo
(h) alcohol t-butílico +
C6H6 + H2SO4
5. En los últimos años,
en Gran Bretaña fueron detenidos (cortésmente) miles de automovilistas e invitados
a soplar en un analizador de la respiración, que consiste en un tubo de vidrio
con silicagel impregnado de ciertos reactivos químicos, que conduce a una bolsa
plástica. Si en más de la mitad del tubo
el color amarillo original se vuelve verde, el automovilista pierde la sonrisa
y enrojece. ¿Cuáles son los reactivos que impregnan al gel de sílice? ¿Por qué
se pone verde el tubo y enrojece el automovilista?
6. Disponga los
alcoholes de cada conjunto por orden de reactividad hacia HBr acuoso:
(a) los alcoholes
pentílicos isómeros del problema 1(a),
del capítulo 17. (Observación: Puede ser necesario disponerlos en grupos de
reactividad semejante.)
(b) 1-fenil-1-propanol,
3-fenil-1-propanol, 1-fenil-2-propanol
(c) alcohol bencílico,
alcohol p-cianobencílico, alcohol p-hidroxibencílico
(d) 2-buten-1-ol,
3-buten-1-ol
(e) ciclopentilmetanol,
1-metilciclopentanol, trans-2-metilciclopentanol
(f) alcohol bencílico,
difenilmetanol, metanol y trifenilmetanol
7. Desarrolle todos los
pasos para una posible síntesis de laboratorio de cada uno de los siguientes
compuestos, partiendo del ciclohexanol y de todos los reactivos alifáticos,
aromáticos o inorgánicos necesarios.
(a) ciclohexanona (C6H10O) (g)
trans-1,2-dibromociclohexano
(b) bromociclohexano (h)
ciclohexilmetanol
(c) 1-metilciclohexanol (I)
1-bromo-1-fenilciclohexano
(d) 1-metilciclohexeno (j) ácido
ciclohexanocarboxílico
(e)
trans-2-metilciclohexanol (k)
ácido adípico, HOOC(CH2)4COOH
(f) 1-ciclohexiletanol (l) norcarano
(véase Sec. 5.8)
8 Desarrolle todos los
pasos de una posible síntesis de laboratorio para cada uno de los siguientes
compuestos, a partir de benceno, tolueno y alcoholes de cuatro carbonos o
menos.
(a)
2,3-dimetil-2-butanol (l)
trans-1,2-dimetilciclopropano
(b) 2-fenil-2-propanol (m)
1-cloro-1-feniletano
(c) 2-fenilpropeno (cloruro de a-feniletilo)
(d) 2-metil-1-buteno (n)
sec-butilbenceno
(e) isopentano (o)
isopropil metil cetona (II)
(f)
1,2-dibromo-2-metilbutano (p)
2-metilhexano
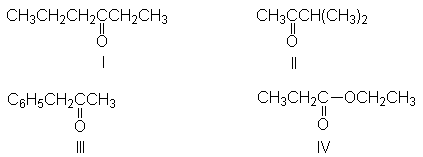
(g) 3-hexanol (q)
bencil metil cetona (III)
(h) 3-hexanona (I) (r)
2,2-dimetilhexano
(i)
4-etil-4-heptanol (s)
2-bromo-1-fenilpropano
(j)
2-bromo-2-metilhexano (t)
3-heptino
(k) metilacetileno (u)
propionato de etilo (IV)
9. Los compuestos
marcados con átomos isotópicos en diversas posiciones son útiles para
determinar mecanismos de reacción y seguir el destino de sustancias en los
sistemas biológicos. Desarrolle una síntesis posible para cada uno de los
siguientes compuestos marcados, empleando 14CH3OH como
fuente de 14C, y D2O como fuente de deuterio.
(a) 2-metil-1-propanol-1-14C,
(CH3)2CH14CH2OH
(b) 2-metil-1-propanol-2-14C,
(CH3)214CHCH2OH
(c) 2-metil-1-propanol-3-114C,
14CH3CH(CH3)CH2OH
(d) propeno-1-14C, CH3CH=14CH2
(e) propeno-2-14C, CH314CH=CH2
(f) propeno-3-14C, 14CH3CH=CH2
(g) C6H5D
(h) CH3CH2CHD14CH3
10. Cuando se trata el
trans-2-metilciclopentanol con cloruro de tosilo, y el producto, con t-butóxido
de potasio, se obtiene un solo alqueno, 3-metilciclopenteno. (a) ¿Cuál es la estereoquímica
de esta reacción? (b) Este es el paso final de una vía general de síntesis
hacia el 3-alquilciclopentenos a partir de la ciclopentanona. Desarrolle todos
los pasos de esta vía, eligiendo cuidadosamente sus
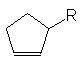
reactivos para cada
paso. (c) ¿Qué ventaja tiene esta secuencia sobre una análoga que implica un
halogenuro intermediario en lugar de un tosilato?
11. Usando todo reactivo
orgánico o inorgánico necesario, indique todos los pasos para la conversión de:
(a) androst-9(11)-eno
(Cap. 17, Problema 8) en el derivado 11-cetónico saturado.
12. Asigne estructuras a
los compuestos A hasta HH.
(a) etileno + CI2(ac)
® A (C2H5OCI)
A + NaHCO3(ac) ® B (C2H6O2)
(b) etileno + CI2(ac)
® A (C2H5OCI)
A + HNO3 ® C (C2H3O2CI)
C + H2O ® D (C2H4O3)
(c) E + 6HIO4 ® 6HCOOH
(d) F (C18H34O2)
+ HCO2OH ® G(C18H36O4)
G + HIO4
®
CH3(CH2)7CHO
+ OHC(CH2)7COOH
(e) alcohol alílico + Br2/CCI4
® H (C3H6OBr2)
H + HNO3
®
I (C3H4O2Br2)
I + Zn ®
J (C3H4O2)
(f)
1,2,3-tribromopropano + KOH (alc) ® K (C3H4Br2)
K + NaOH
(ac) ®
L (C3H5OBr)
L + KOH (alc) ® M (C3H4O)
(g)
2,2-dicloropropano + NaOH (ac) ® NC3H8O2 ® O(C3H6O)
(h) propino + CI2(ac) ® P(C3H6O2CI2) ® Q(C3H4OCI2)
Q + CI2(ac)
®
R(C3H3OCI3)
R + NaOH(ac) ®
CHCI3 + S(C2H3O2Na)
(i) ciclohexeno + KMnO4
® T(C6H12O2)
T + CH3COOH, H+ ® U(C10H16O4)
(j) V(C3H8O3) + CH3COOH,
H+ ® W(C9H14O6)
(k) ciclohexanol + K2Cr2O7,
H+ ® X(C6H10O)
X + C6H5MgBr,
seguido de H2O ® Y(C12H16O)
Y
+ calor ® Z(C12H24)
Z + KMnO4/NaIO4 ® AA(C12H14O3)
(l) (R)-(+)-1-bromo-2,4-dimetilpentano + Mg ® BB
BB + (CH3)2CHCH2CHO,
luego H2O ® CC(C12H26O), una mezcla
CC + CrO3 ®DD(C12H24O)
DD + CH3MgBr, luego H2O
® EE(C13H28O), una mezcla
EE + I2, calor ® FF(C13H26), una mezcla
FF + H2,
Ni ®
GG(C13H28) + HH(C13H28)
Opticamente Opticamente
activo inactivo
13. Cuando se disuelve
1,4-hexadien-3-ol en H2SO4, se convierte completamente en
3,5-hexadien-2-ol. ¿Cómo se explica esto?
14. Cuando se disuelve
1,3,5,5-tetrametil-1,3-ciclohexadieno en H2SO4 concentrado y frío, la solución
presenta un descenso del punto de congelación que corresponde a dos partículas por
cada molécula de dieno disuelta. Al añadir agua a la solución, el dieno se
regenera por completo. ¿Cómo se explican estas observaciones? ¿Qué está
sucediendo y por qué?
15. El atrayente sexual
de la polilla de penacho del abeto de Douglas se ha sintetizado de la siguiente
manera:
1-heptino + LiNH2 ® II (C7H11Li)
II +
1-cloro-3-bromopropano ® JJ(C10H17CI)
JJ + Mg; luego n-C10H21CHO;
luego H+ ® KK(C21H40O)
KK + H2,
catalizador de Lindlar ® LL(C21H42O)
LL + CrO3 ® atrayente sexual (C21H40O)
Dése la estructura del
atrayente sexual y de todos los compuestos intermedios.
16. El
triciclopropilcarbinol (R3COH, R= ciclopropilo) produce un espectro
RMN complejo en la región & 0.2-1.1 y es transparente en el ultravioleta
cercano. Una solución del alcohol en H2SO4 concentrado
tiene las propiedades siguientes:
(1) Un descenso del
punto de congelación correspondiente a cuatro partículas por cada molécula
disuelta;
(2) absorción
ultravioleta intensa ( l máx 270 nm, e máx 22 000);
(3) un espectro RMN con
un solo pico, singulete, & 2.26.
Cuando se diluye y
neutraliza la solución, se recupera el alcohol original.
(a) ¿Qué sustancia se
genera en la solución de ácido sulfúrico? Indique cómo explica su formación
cada uno de los hechos (1)-(3). ¿Cómo se explica la estabilidad evidente de
esta sustancia?
(Indicación: Véase Secs.
12.9 y 15.17.)
(b) Una solución de
2-ciclopropil-2-propanol en ácido fuerte da el espectro RMN siguiente:
a singulete, & 2.60, 3H; b
singulete, & 3.14, 3H; c multiplete, & 3.5-4, 5 H
Una solución similar de
2-ciclopropil-1,1,1-trideuterio-2-propanol da un espectro análogo, excepto que
a y b se reducen a la mitad de sus áreas originales.
¿Qué coclusión general
puede sacarse sobre las ubicaciones relativas de los dos grupos metilos? ¿Puede
sugerir una geometría específica para esta molécula que sea consistente no sólo
con este espectro, sino también con la respuesta al apartado (a)? (Indicación:
Utilice modelos.)
17. Describa ensayos químicos símples que sirvan para
distinguir entre:
(a) alohol n-butílico y
n-octano (f)
3-pentanol y 1-pentanol
(b) alcohol n-butílico y
1-octeno (g)
3-pentanol y 2-pentanol
(c) alcohol n-butílico y
bromuro de n-pentilo (h) 2-bromoetanol y
alcohol n-butílico
(d) alcohol
n-butílico y 3-buten-1-ol (i) 1,2-propanodiol y
1,3-propanodiol
(e) 3-buten-1-ol y
2-buten-1-ol (j)
alcohol n-butílico y alcohol t-pentílico
Describa lo que haría y observaría.
18. Identifique cada uno
de los siguientes isómeros de fórmula C20H18O:
Isómero MM (p.f. 88ºC)
a singulete, & 2.23,
1H; b singulete, & 3.92, 1H, J=7 Hz;
c doblete, & 4.98,
1H, J=7 Hz; d singulete, & 6.81, 10H; e singulete, & 6.99, 5H
Isómero NN (p.f.88ºC)
a singulete, & 2.14,
1H; b singulete, & 3.55, 2H; c pico ancho, & 7.25, 15H
¿Qué ensayo químico simple
único puede diferenciar entre estos dos isómeros?
19. Proponga una
estructura, o estructuras, que concuerden con cada uno de los espectros RMN
protónica de la figura 18.2.
20 proponga una
estructura, o estructuras, que concuerden con cada uno de los espectros RMN
protónica de la figura 18.3.
21. Proponga una
estructura, o estructuras, que concuerde con cada uno de los espectros RMC de
la figura 18.4.
22. Por hidrogenación,
el compuesto OO(C4H8O) se convierte en PP(C4H10O).
A partir de sus espectros de infrarrojo (Fig. 18.5) de las fórmulas
estructurales de OO y PP.
23. Proponga una
estructura, o estructuras, del compuesto QQ, cuyos espectros de infrarrojo y
RMN protónica se presentan en las figuras 18.6 y 18.7.
24. Proponga una
estructura, o estructuras, del compuesto RR, cuyos espectros RMC y RMN
protónica se presentan en la figura 18.8.
25. El geraniol, C10H18O,
un terpeno que se encuentra en el aceite de rosa, produce los espectros RMC y
RMN protónica que se muestran en la figura 18.9. En el siguiente problema se
proporcionan las pruebas químicas a
partir de las cuales se puede deducir su estructura; sin embargo, antes de
trabajar con ese problema, veamos cuánta información puede obtenerse únicamente
de los espectros.
(a) Examine el espectro
infrarrojo. ¿Es el geraniol alifático o aromático? ¿Qué grupo funcional está
claramente presente? Analizando la fórmula molecular ¿qué otros agrupamientos
pueden estar presentes en la molécula? ¿Confirma su presencia el espectro
infrarrojo?
(b) Examine el espectro
RMC. ¿Cuántas señales tiene? ¿Qué similitud tiene con el número de carbonos de
la fórmula molecular? ¿Qué indica esto sobre la molécula de geraniol?
(c) Analice ahora la
multiplicidad enlistada para las señales de RMC. ¿Cuántos hidrógenos están
unidos a cada carbono? ¿Cuántos grupos metilo (de haberlos) se indican?
¿Cuántos grupos metileno? ¿Cuántos carbonos tienen unido sólo un hidrógeno?
¿Cuántos no tienen ninguno?
(d) Hasta este momento,
¿cuántos carbonos e hidrógeno pueden justificarse con el espectroRMC? ¿Qué
átomos, de haberlos, faltan todavía? ¿Qué grupo funcional está probablemente
presente? ¿Concuerda esto con lo observarlo en el espectro infrarrojo? De
acuerdo con los valores &, ¿quécarbono del espectro RMC está unido al grupo
funcional? ¿Cuántos hidrógenos tiene dicho carbono?
(e) Las señales q, h, i
y j del espectro RMC están alejadas de las otras seis. Examinando la fórmula
molecular del geraniol, los valores & y las conclusiones a las que se llegó
por el espectro RMC, ¿es alifático o aromático? Si es aromático ¿cuántos
anillos tiene? Si es alifático ¿cuántos dobles enlaces tiene ( si los tiene)?
¿Tiene dobles enlaces carbono-oxígeno?
(f) En el espectro RMN
protónica, asígnese el número de protones de cada señal basándose en la curva
de integración. A partir de los valores de los desplazamientos químicos y
recordando la información del infrarrojo, ¿qué tipo de protón produce cada
señal?
(g) Después de agitar el
geraniol con D2O, desaparece el pico de RMN protónica de & 3.32.
¿Por qué?
(h) Dibuje los
agrupamientos probables de la molécula indicados en RMN protónica. ¿Cuántos
grupos metilo tiene (si los tiene)? ¿Cuántos grupos metileno? ¿Cuántos protones
vinílicos o alílicos? ¿Qué relación sugieren los valores de desplazamiento
químico, desdoblamiento, etc., entre dichos agrupamientos?
(i) Ahora, utilizando
toda la información disponible, trate de unir las piezas y dibuje estructuras
posibles para el geraniol. Teniendo en cuenta la fuente de geraniol, ¿hay alguna estructura más probable que otras?
26. El geraniol, C10H18O,
terpeno que se encuentra en el aceite de rosas, adiciona dos moles de bromo,
para formar un tetrabromuro, C10H18OBr4. Se
puede oxidar a un aldehído, o a un ácido carboxílico, de 10 carbonos. Por
oxidación vigorosa, el geraniol da:
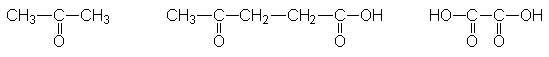
(a) Recordando la regla
isoprénica (Sec. 10.31), ¿Cuál es la estructura más probable del geraniol? (b)
El nerol (Cap. 12, Problema 26) puede convertirse en el mismo alcohol saturado
que da el geraniol y proporciona los mismos productos de oxidación que el
geraniol; sin embargo, tiene propiedades físicas diferentes. ¿Cuál es la
relación estructural más probable entre geraniol y nerol? c) El ácido sulfúrico
convierte al geraniol en a-terpineol (Cap. 12, Problemas 26), al igual que al
nerol, pero mucho más lentamente. Con esta base, ¿qué estructuras se podrían
asignar el nerol y al geraniol? (Indicación: Utilícense modelos.)
27. Por tratamiento con
HBr, el geraniol (Problema anterior) y el linalool (del aceite de lavándula,
bergamota, cilantro), dan el mismo bromuro, de fórmula C10H17Br.
¿Cómo explica este hecho?
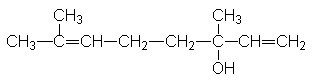
Linalool