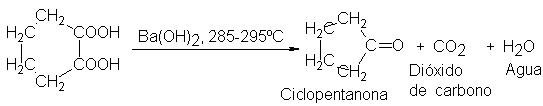Página principal http://organica1.org
ANHIDRIDOS DE
ACIDO
Preparación de
anhídridos de ácido
Sólo un
anhídrido de ácido
monocarboxílico es de
uso común: el
anhídrido acético, cuya
importancia es enorme.
Se prepara por
la reacción del
ácido acético con
cetena, CH2=C=O, que,
a su vez,
se obtiene por
deshidratación del ácido acético
a temperaturas elevadas.
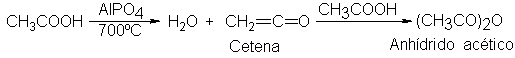
La cetena
es un compuesto
interesante y muy
reactivo, que hemos
mencionado como fuente
de metileno. En
laboratorio se obtiene
por pirólisis de
acetona y se
suele utilizar de
inmediato.
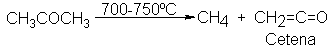
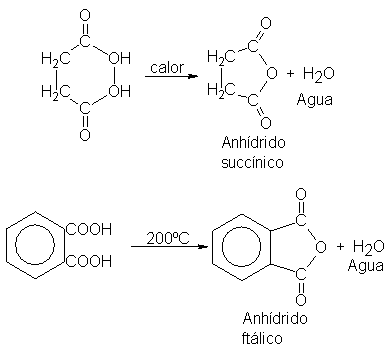
En contraposición con los ácidos monocarboxílicos, ciertos ácidos di-carboxílicos generan anhídridos por simple calentamiento: se trata de aquellos que pueden formar anillos de cinco o seis átomos. Por ejemplo:
El tamaño
del anillo es
crucial: con ácido
adípico, por ejemplo,
la formación del
anhídrido generaría un
anillo de siete
átomos, por lo
que no tiene
lugar; en cambio,
se pierde dióxido
de carbono para
formar ciclopentanona, una
cetona con un
anillo de sólo
cinco átomos.