Página principal http://organica1.org
Sustitución nucleofílica: alquilo
contra acilo
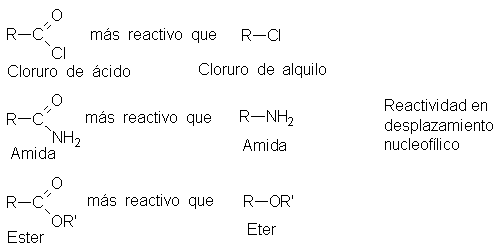
Establecimos que
la sustitución nucleofílica
es más fácil
en un carbono
de acilo que
en uno saturado.
Así, en un
ataque nucleofílico son
más reactivos los
cloruros de ácido que los
de alquilo, las amidas
resultan más reactivas
que las aminas
(RNH2), y los
ésteres, más reactivos
que los éteres.
Es evidente
que es el
grupo carbonilo el
que hace los
compuestos de acilo
más reactivos que
los de alquilo.
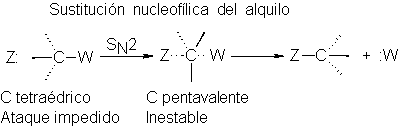
El ataque nucleofílico
(SN2) sobre un
carbono alquílico tetraédrico
supone un estado de transición
muy compacto que
contiene carbón pentavalente;
debe romperse un
enlace para permitir
la entrada del nucleófilo:
El ataque
nucleofílico sobre un
compuesto de acilo
plano supone un
estado de transición relativamente libre
de impedimento que
conduce a un
intermediario tetraédrico, que,
de hecho, es
un compuesto. Puesto
que el grupo
carbonilo es no
saturado, la unión
del
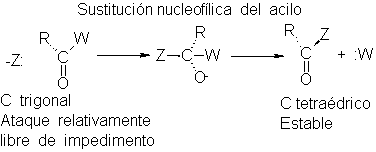
Nucleófilo sólo
requiere la ruptura del
enlace n débil,
con la ubicación
de una carga
negativa sobre un
átomo bien dispuesto
a aceptarla, o
sea, oxígeno.