Página principal http://organica1.org
Sustitución nucleofílica
del acilo.
Papel
del grupo carbonilo
Antes de
tratar por separado cada
tipo de derivado
de ácido, será
útil delinear ciertas
normas generales en las
que poder ajustar
los bastantes numerosos hechos individuales.
Cada derivado
se prepara casi
siempre a partir
del ácido carboxílico
correspondiente, directa o
indirectamente, pudiendo ser
reconvertido en este
último por simple
hidrólisis. Gran parte
de la química
de los derivados
de ácidos involucra
su interconversión y la reconversión
en el ácido matriz.
Además, cada derivado
tiene ciertas reacciones
características propias.
Los derivados,
como los propios
ácidos, contienen el grupo carbonilo,
C=O, el cual
es retenido en los
productos de la
mayoría de sus
reacciones y no
sufre cambios permanentes.
Sin embargo,
su presencia en la molécula
determina a reactividad
característica de estos
compuestos, y es
la clave para
comprender su química.
También aquí,
al igual que en aldehídos
y cetonas, el
grupo carbonilo cumple
dos funciones: (a) proporciona un
sitio para el
ataque nucleofílico y
(b) aumenta la
acidez de los
hidrógenos unidos al
carbono alfa.
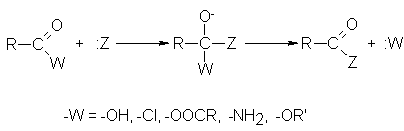
Como característica común,
los compuestos de
acilo -ácidos carboxílicos
y sus derivados
sufren sustitución nucleofílica,
donde se reemplaza
-OH, -CI, -OOCR,
-NH2 u -OR’ por
algún otro grupo
básico. En estos
casos, la sustitución
resulta más rápida
que la de
un carbono saturado.
De hecho, muchas
de estas sustituciones
ni siquiera se realizan
en ausencia del
grupo carbonilo, como,
por ejemplo, el
reemplazo de -NH2 por
-OH.
Para justificar
las propiedades de los compuestos
de acilo, observemos
una vez más
el grupo carbonilo,
ya estudiado en
aldehídos y cetonas
(Secs. 21.1 y 21.7),
por lo que
se sabe cuál
es su estructura
y qué esperar
de él.
El carbono
carbonílico está unido
a tres átomos
por enlaces o,
que, por utilizar
orbitales sp2 ,se encuentran
en un plano
separados entre sí 120º.
El orbital p
restante del carbón
solapa un orbital
p del oxígeno
para establecer un enlace
n, por lo
que carbono y
oxígeno se unen
por un doble
enlace. La parte
de la molécula que
rodea al carbono
carbonílico es plana,
o sea, el
oxígeno, el carbono
carbonílico y dos átomos
unidos directamente a este último
se hallan en
un plano:
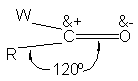
Anteriormente habíamos
visto que el
grupo carbonilo es
muy susceptible al
ataque nucleofílico en
su carbón, debido
a factores electrones
y estéricos: (a)
la tendenca del
oxígeno a adquirir
electrones, aun a
costa de ganar
una carga negativa,
y (b) el
estado de transición
relativamente poco impedido
que conduce del
reactivo trigonal al
intermediario tetraédrico. Estos
mismos factores hacen
que los compuestos
de acilo sean
susceptibles al ataque
nucleofílico (Fig. 24.1).
Las sustancias
acílicas difieren de
aldehídos y cetonas
en el segundo
paso de la
reacción.
El intermediario
tetraédrico que se
origina para un
aldehído o una
cetona gana un
protón,
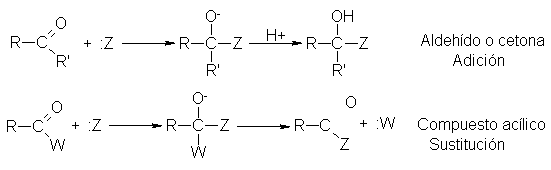
Por lo que
el resultado es una
adición. El intermediario
tetraédrico de un
compuesto de acilo
expulsa al grupo
:W, retornado a una
sustancia trigonal, siendo
el resultado una
sustitución.
Podemos apreciar
por qué difieren las
dos clases de
sustancias: la facilidad con
que se pierde
:W depende de
su basicidad; cuanto
más débil sea
la base mejor
será el grupo
saliente.
Para cloruros
y anhídridos de
ácidos, ésteres y
amidas, :W es,
respectivamente, la base
muy débil CI-,
la moderadamente débil
RCOO-, y las
bases fuertes R’O
y NH2-. Pero
para que un
aldehído o una
cetona sufran sustitución,
el grupo saliente
tendrá que ser
un ion hidruro (:H-)
o alquiluro (:R-),
que, como sabemos, son
las bases más
fuertes de todas.
(Compruébese la
baja acidez de H2 y RH.)
Así pues, en
casi todos los
casos aldehídos y cetonas sufren
adición y no
sustitución.
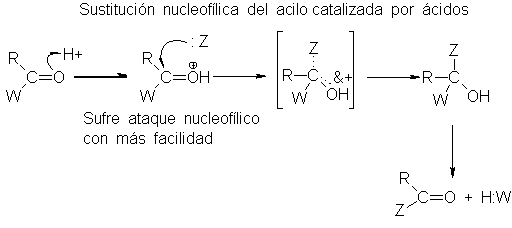
Así, la sustitución
nucleofílica del acilo
procede en dos
etapas, con formación
intermediaria de un
copuesto tetraédrico. Generalmente,
la
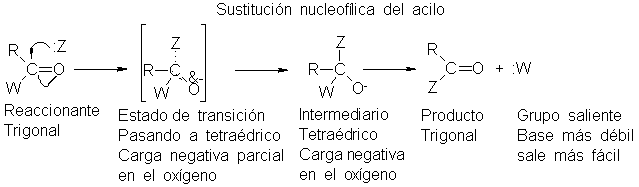
 velocidad total
de la reacción se ve afectada
por los dos
pasos, pero el
primero es el
más importante. La
primera etapa, la
formación del intermediario
tetraédrico, sufre los
efectos de los
mismos factores que
operan
velocidad total
de la reacción se ve afectada
por los dos
pasos, pero el
primero es el
más importante. La
primera etapa, la
formación del intermediario
tetraédrico, sufre los
efectos de los
mismos factores que
operan
En la
adición a aldehídos
y cetonas: es
favorecida por la
atracción de electrones,
lo que estabiliza
la carga negativa
en desarrollo; y
es retardada por
la presencia de
grupos voluminosos que
se aglomeran en
el estado de
transición. La segunda
etapa depende, como
vimos, de la
basicidad del grupo
saliente, :W.
En medio
ácido, se une
H+ al oxígeno
carbonílico, por lo que el
grupo carbonilo queda
aún más propenso
al ataque nucleofílico,
puesto que el
oxígeno puede adquirir
ahora electrones n
sin aceptar una
carga negativa.
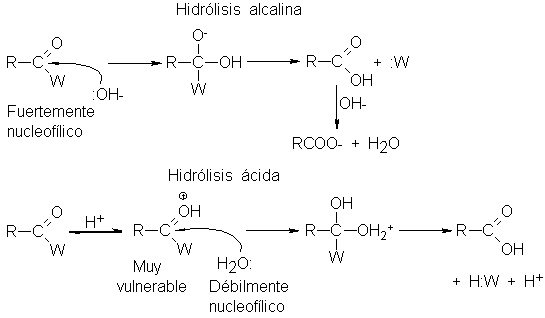 Es comprensible
que los derivados
de ácidos sean
hidrolizados más rápidamente
en solución ácida
básica que en
neutra: las soluciones
alcalinas proporcionan iones hidróxido
que actúan como
reactivos nucleofílicos poderosos;
las ácidas, en
cambio, permiten que
se una un ion
hidrógeno al oxígeno
carbonílico, por lo
que la molécula
queda más vulnerable al
ataque del agua,
que es un reactivo
débilmente nucleofílico.
Es comprensible
que los derivados
de ácidos sean
hidrolizados más rápidamente
en solución ácida
básica que en
neutra: las soluciones
alcalinas proporcionan iones hidróxido
que actúan como
reactivos nucleofílicos poderosos;
las ácidas, en
cambio, permiten que
se una un ion
hidrógeno al oxígeno
carbonílico, por lo
que la molécula
queda más vulnerable al
ataque del agua,
que es un reactivo
débilmente nucleofílico.