Página principal http://organica1.org
Hidrólisis ácida
de los ésteres
No son
sólo las bases
las que promueven
la hidrólisis de
ésteres, también lo
hacen los ácidos.
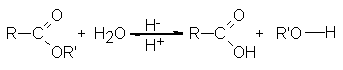
La hidrólisis
ácida es reversible,
como ya sabemos.
Por lo
que el mecanismo
de la hidrólisis
es también el
de la esterificación, pero
considerado en el
sentido opuesto. Toda
evidencia para una
de las reacciones
debe ser válida
para ambas.
El mecanismo
para la hidrólisis
ácida y la
esterificación está contenido
en los equilibrios
siguientes:
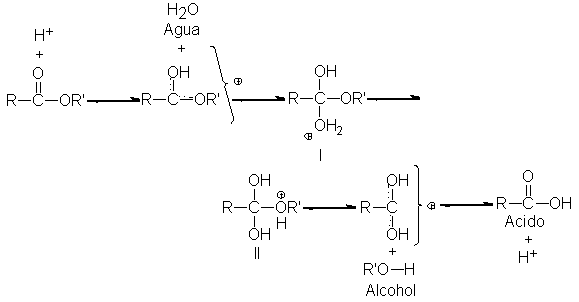
Un ácido mineral
acelera ambos procesos
protonando el oxígeno
carbonílico, con lo que
el carbono del
grupo resulta más
susceptible al ataque nucleofílico. En
la hidrólisis el
nucleófilo es una
molécula de agua,
mientras el grupo
saliente es un
alcohol; en la
esterificación, en cambio,
se invierten exactamente
los papeles.
Como en
la hidrólisis alcalina,
aquí también hay
casi con certeza
un intermediario tetraédrico
o, quizá, varios.
Se requiere más
de un intermediario, debido,
entre otras cosas,
a la naturaleza
reversible de la
reacción. Considerando sólo
la hidrólisis, es
probable la formación
del intermediario II,
puesto que permite
la separación de
la molécula débilmente
básica de alcohol,
en lugar del
ión alcóxido fuertemente
básico; considerando la
esterificación, en cambio,
resulta que II
ciertamente debe estar
implicado, dado que es
el producto del
ataque del alcohol
sobre el ácido
protonado.
La evidencia
para este mecanismo
es la misma que
para la hidrólisis
alcalina. Se ha
comprobado la posición
de la ruptura, RCO-OR’
y RCO-OH, por medio
de estudios con
18º, tanto para
la hidrólisis como
para la esterificación. La
existencia de los
intermediarios tetraédricos ha
sido demostrada por
el intercambio de
18º entre el
oxígeno carbonílico del
éster y el
disolvente, como se
hizo en el
proceso alcalino.