Página principal http://organica1.org
Hidrólisis alcalina
de los ésteres
Cuando se
le calienta con
ácido o base
acuosos, un éster
carboxílico es hidrolizado
al ácido correspondiente y
a un alcohol
o fenol. Entonces,
si se trabaja
en condiciones alcalinas,
se obtiene el
ácido en forma de
una sal. El
ácido puede liberarse
por adición de
ácido mineral.
Una base
promueve la hidrólisis
de ésteres porque proporciona
el reactivo fuertemente
nucleofílico OH-. Esta
reacción es irreversible
esencialmente, puesto que
un anión carboxilato
estabilizado por resonancia demuestra
poca tendencia a
reaccionar con un
alcohol.
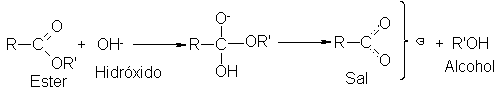
Observamos los
diversos aspectos del
mecanismo presentado y
veamos la evidencia para cada
uno.
En primer
lugar, tenemos el ataque
del ión hidróxido
sobre el éster.
Esto concuerda con
la cinética, que
es de segundo
orden, por depender
la velocidad de la concentración
de éster y de la
del hidróxido.
Luego, el
hidróxido ataca en
el carbono carbonílico
y desplaza al ión alcóxido;
es decir,
La reacción
implica la ruptura
del enlace entre
el oxígeno y
el grupo acilo,
RCO-OR’. Para ello
disponemos de dos
líneas de evidencia, siendo
la primera de ellas
la estereoquímica.
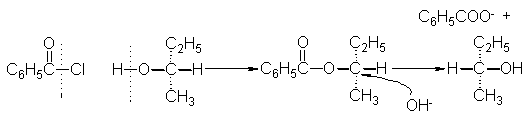
A modo
de ejemplo, consideremos
la formación y
posterior hidrólisis de
un éster del alcohol
sec-butílico ópticamente activo. La
reacción de este
último con cloruro de
benzoilo sólo puede
romper el enlace
hidrógeno-oxígeno, por lo
que no puede
modificar la configuración
en torno al
centro entre el
oxígeno y el
grupo sec-butilo, cabe
esperar casi con
certeza una inversión
(o inversión más
racemización, si la
reacción procede por
un mecanismo del
tipo SN1):
Por otra parte, si durante la hidrólisis queda intacto el enlace entre el oxígeno y el grupo sec-butilo, debería obtenerse alcohol sec-butílico de la misma configuración que la del material inicial:
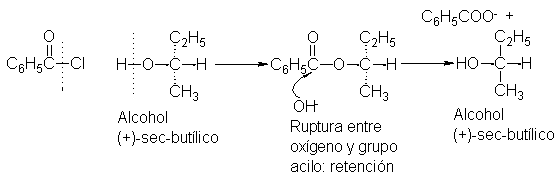
Cuando el
alcohol sec-butílico de
rotación + 13.8º
se convirtió en
el benzoato, y
este se hidrolizó
con álcali, se
obtuvo alcohol sec-butílico
de rotación +
13.8º. Esta retención
completa de la
configuración es una
indicación importante de
que la ruptura de
la unión ocurre
entre el oxígeno
y el grupo
acilo.
Estudios con
trazadores han confirmado el
tipo de ruptura
que indica la
estereoquímica.
Al ser
hidrolizado propionato de
etilo marcado con
18º en agua ordinaria
con una base,
se encontró que
el etanol producido
estaba enriquecido con
18º, mientras que
el ácido propiçonico sólo contenía la
cantidad ordinaria de
18º:
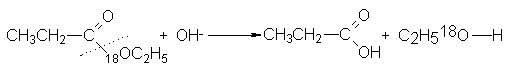
El grupo
alcohólico había retenido
el oxígeno con
el que estaba
unido al éster;
la ruptura había
ocurrido entre el oxígeno
y el grupo
acilo.
Estudios de
muchas otras hidrólisis,
tanto con métodos
trazadores como con estereoquímicos, han
revelado que la
ruptura entre el oxígeno
y el grupo
acilo es la
normal en el
caso de los
ésteres, lo que
indica que el
punto preferencial del
ataque nucleofílico es
el carbono carbonílico
y no el
alquílico. En vista
de la mayor
reactividad general del
carbono carbonílico, esto
es, desde luego,
lo que cabía
esperar.
Finalmente, y
en concordancia con el mecanismo,
el ataque del
ión hidróxido al carbono
carbonílico no desplaza
al ión alcóxido en
un solo paso,
sino en dos,
con la formación
intermedia de un
compuesto tetraédrico.
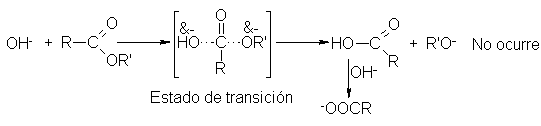
Bender llevó
a cabo la
hidrólisis alcalina del
benzoato de etilo
marcado en el
carbonilo, C6H5C18OOC2H5, en
agua ordinaria, y
fijó su atención
en el reactivo
en vez del producto.
Interrumpió la
reacción en varios
periodos, aisló el
éster no consumido
y analizó su
contenido en 18º.
Encontró que en
la solución alcalina
el éster no
sólo estaba sufriendo
hidrólisis, sino también
un intercambio de
su 18º por
el oxígeno ordinario
del disolvente.
El intercambio
de oxígeno no
concuerda con el
mecanismo de una
etapa, por lo
que no ocurre;
concuerda, sin embargo,
con uno de
dos pasos, en el
que no
sólo se forma
el intermediario I,
sino que parte
se reconvierte en
el material de
partida, y parte
se transforma en
III (probablemente por
intermedio de la
especie neutra II),
un intermediario equivalente
a I, salvo por la
ubicación de la
marca. Si el
proceso ocurre realmente
así, entonces la
<<regresión >> del
intermediario III al
<<material inicial >>
da éster
que ha perdido
su 18º.
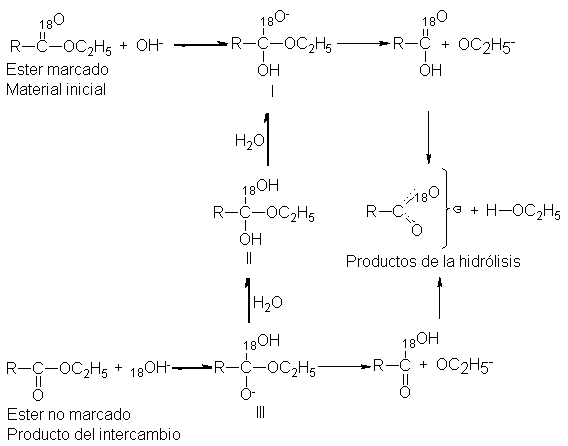
El trabajo
de Bender no
comprueba el mecanismo que hemos
desarrollado. Es concebible
que el intercambio
de oxígeno, y
por consiguiente el
intermediario tetraédrico, represente
simplemente una vía
ciega por la
que se aventuran
las moléculas de éster,
pero sin conducir a
la hidrólisis. Sin
embargo, tal coincidencia
es poco probable,
particularmente por ciertas
relaciones cinéticas entre
el intercambio de
oxígeno y la
hidrólisis.
Experimentos similares
indican la formación
reversible de intermediarios tetraédricos
en la hidrólisis
de otros ésteres,
amidas, anhídridos y
cloruros de ácidos,
que son la
base del mecanismo
general ilustrado para
la sustitución nucleofílica
sobre el acilo.
Los experimentos
de intercambio también
son el fundamento
de nuestra apreciación
de la importancia
relativa de los
dos pasos: las
diferencias en la velocidad
de la hidrólisis de
derivados de ácidos dependen principalmente de la
velocidad de formación
de los intermediarios, y
también de la
fracción de éstos que
continúa a producto.
Como establecimos, la
velocidad de reacción
de formación del
intermediario depende de
factores electrónicos y
estéricos: en el
estado de transición se
desarrolla una carga
negativa y el
carbono cambia de
trigonal a tetraédrico.
Incluso en
los casos donde
no puede detectarse
un intercambio de
oxígeno, no podemos
descartar la posibilidad de un
intermediario; puede suceder
que éste prosiga
hasta productos de
hidrólisis mucho más
rápido que lo
que haría cualquiera
otra cosa.