Página principal http://organica1.org
Sales de
los ácidos carboxílicos
Aunque mucho
más débiles que
los ácidos minerales
fuertes (sulfúrico, clorhídrico,
nítrico), los ácidos
carboxílicos son sustancialmente más
ácidos que los
orgánicos muy débiles estudiados hasta
el momento (alcoholes,
acetileno); son mucho
más ácidos que el
agua, por lo
que los hidróxidos
acuosos los convierten
en sus sales
con facilidad, y
los ácidos minerales
acuosos reconvierten las
sales en los
ácidos carboxílicos correspondientes. Como
es poco lo
que podemos hacer
con ácidos carboxílicos
sin tropezar con
esta conversión en
sus sales, y
viceversa, vale la
pena examinar las
propiedades de estas
últimas.
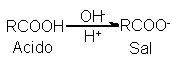
Al igual
que todas las
sales, las de
los ácidos carboxílicos
con sólidos cristalinos
no volátiles, constituidas
por iones positivos
y negativos, y sus
propiedades corresponden a
dichas estructuras. Las
considerables fuerzas electrostáticas que mantienen a
los iones en
el retículo cristalino,
sólo pueden superarse
por un calentamiento
a temperatura elevada
o por medio
de un disolvente
muy polar. La
temperatura requerida para
fundirlas es tan
alta que antes
de lograrla se rompen
los enlace carbono-carbono y
se descompone la
molécula, generalmente entre
los 300-400 ºC. Raras
veces es útil
un punto de
descomposición para la
identificación de una
sustancia, pues normalmente
sólo refleja la
velocidad de calentamiento
y no la
identidad del compuesto.
Las sales
de metales alcalinos
de los ácidos
carboxílicos (sodio, potasio,
amonio) son solubles
en agua, pero
no en disolventes no
polares; la mayoría
de las sales
de metales pesados (hierro,
plata, cobre, etc.)
son insolubles en
agua.
Podemos apreciar
así que, salvo
en el caso
de ácidos de
cuatro carbonos o
menos, solubles tanto
en agua como en
disolventes orgánicos, los
ácidos carboxílicos y
sus sales de
metales alcalinos exhiben
un comportamiento de
solubilidad exactamente opuesto.
Debido a la
fácil interconversión de
ácido y sus
sales, este comportamiento se
puede utilizar de dos formas
importantes: para la
identificación y para
la separación.
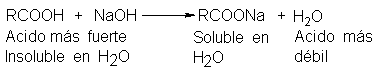
Un compuesto
orgánico insoluble en
agua que se
disuelve en hidróxido
de sodio acuoso,
diluido y frío,
debe ser un
ácido carboxílico o
uno de los
pocos otros tipos de compuestos
orgánicos más ácidos
que el agua.
Que es efectivamente
un ácido carboxílico
puede demostrarse de
otras maneras.
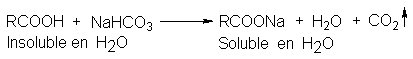
En lugar
de hidróxido de sodio
podemos usar bicarbonato
de sodio acuoso.
Aunque la sustancia
desconocida sea soluble
en agua, queda
comprobada su acidez
por el burbujeo de
CO2.
Podemos separar
un ácido carboxílico
de compuestos no
ácidos aprovechando su
solubilidad y la
insolubilidad en base
acuosa. Una vez
lograda la separación,
regeneramos el ácido
por acidulación de
la solución acuosa. Si
trabajamos con sólidos, simplemente
agitamos la mezcla
con base acuosa
y luego filtramos
la solución para
separar las sustancias
no ácidas insolubles.
La adición de
ácido al filtrado
precipita el ácido
carboxílico, el cual puede
recogerse por filtración.
Si estamos trabajando
con líquidos, agitando
la mezcla con
base acuosa en
un embudo de
decantación y separamos
luego la capa acuosa
de la orgánica
insoluble. La acidificación
de la fase acuosa
nuevamente libera al
ácido carboxílico, que
puede separarse del
agua. Para que
la separación sea
completa y de
fácil manipulación, a
menudo agregamos un
disolvente insoluble en
agua, como éter,
a la mezcla
acidificada. El ácido
carboxílico es extraído
del agua por
el éter, en
el que es más
soluble. El éter
volátil se separa
con facilidad por destilación,
ya que el
ácido hierve a
temperatura relativamente elevada.
Así,
por ejemplo, un
aldehído que se
prepara por oxidación
de un alcohol
primario, es posible
que esté contaminando
con el ácido
carboxílico correspondiente, el
cual puede eliminarse
por simple lavado
con una base
acuosa diluida. El
ácido carboxílico, preparado
por oxidación de
un alquilbenceno, es
posible que esté
contaminando con material
original no reaccionado:
el ácido carboxílico puede
extraerse con base
acuosa, quedando separado
del hidrocarburo insoluble,
y luego se
regenera por adición
de ácido mineral.
Por ser
las separaciones de
este tipo más
definidas y producir
menor pérdida de
material, siempre que
sea posible son
preferidas a la
recristalización o destilación.