Página principal http://organica1.org
Propiedades físicas
Sus estructuras
hacen suponer que
los ácidos carboxílicos
son moléculas polares, y al
igual que los
alcoholes pueden formar
puentes de hidrógeno
entre sí y
con otros tipos
de moléculas. Por
consiguiente, los ácidos
carboxílicos se comportan
de forma similar
a los alcoholes
en cuanto a
sus solubilidades: los
primeros son miscibles
con agua, el
ácido de cinco
carbonos es parcialmente
soluble y los
superiores son virtualmente
insolubles. No cabe
duda de que
la solubilidad en
agua se debe
a los puentes
de hidrógeno entre
el ácido carboxílico
y el agua.
El ácido aromático
más simple, el
benzoico, contiene demasiados
átomos de carbono
como para tener
una solubilidad apreciable
en agua.
Los ácidos
carboxílicos son solubles
en disolventes orgánicos
menos polares, como
éter, alcohol, benceno,
etc.
En la
tabla 23.1 se
observa que, como
clase, los ácidos
carboxílicos hierven a
temperaturas aún más
elevadas que los
alcoholes. El ácido
propiónico (p.e. 141
ºC), por ejemplo,
hierve a unos
20 ºC más
que el alcohol
de peso molecular
comparable, el n-butílico
(p.e. 118 ºC). Estos puntos de
ebullición tan elevados
se deben a
que un par de moléculas
del ácido carboxílico
se mantienen unidas
no por un
puente de hidrógeno,
sino por dos:
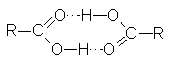
Los olores
de los ácidos
alifáticos inferiores progresan
desde los fuertes
e irritantes del
fórmico y acético,
hasta los abiertamente
desagradables del butírico,
valeriánico y caproico.
Los ácidos superiores
tienen muy poco
olor debido a
sus bajas volatilidades.