Página principal http://organica1.org
Análisis de
los ácidos carboxílicos.
Equivalente de neutralización
Ls ácidos
carboxílicos se reconocen
por su acidez.
Se disuelven en
hidróxido de sodio
acuoso y en
bicarbonato acuoso. La
reacción con bicarbonato
desprende burbujas de
dióxido de carbono
(véase Sec. 23.4).
(Los fenoles,
son más ácidos
que el agua,
pero, con ciertas
excepciones, son mucho
más débiles que
los ácidos carboxílicos;
son solubles en
hidroxido acuoso, pero
no en bicarbonato.
Los ácidos sulfónicos
son aún más
ácidos que los
carboxílicos, pero contienen azufre,
que puede detectarse
por un análisis
elemental.)
Una vez
caracterizada como ácido
carboxílico, una sustancia desconocida
se identifica con
un ácido específico
basándose en la
forma usual de
sus propiedades físicas
y las de
sus derivados. Los
derivados que se
emplean corrientemente son
amidas y ésteres.
Para la
identificación de ácidos
ya estudiados y
la comprobación de
la estructura de
un nuevo, es muy útil
el equivalente de
neutralización: el peso
equivalente de ácido
determinado por titulación
con base normalizada. Se
disuelve una muestra
pesada de ácido
en agua o
alcohol acuoso, y
se mide el
volumen de base
normalizada que se
necesita para neutralizar
la solución. Por
ejemplo, una muestra
de 0.224 g de
un ácido desconocido
(p.f. 139-140ºC) requiere
13.6 ml de
hidróxido de sodio
0.104 N para
su neutralización (
se utiliza fenolftaleína
como indicador). Puesto
que cada 1000
ml de la
base contienen 0.104
equivalentes, y como
el número de
equivaletes de base
requeridos es igual
al número de equivaletes del
ácido presente,
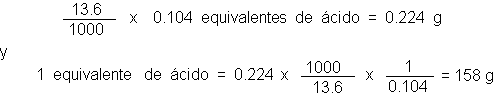
Una sal
metálica de un
ácido carboxílico se
reconoce por las
pruebas siguientes: (a)
deja un residuo
al ser calentada
fuertemente (ensayo de
ignición´); (b) se
descompone a temperatura relativamente
elevada, en vez de fundirse,
y (c) se
convierte en ácido carboxílico
por tratamiento con
ácido mineral diluido.