Página principal http://organica1.org
Conversión a
ésteres
Frecuentemente los
ácidos se convierten
a sus ésteres
por medio de
los cloruros de
ácido:
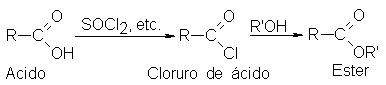
Un ácido
carboxílico se convierte
directamente a un
éster al calentarlo
con un alcohol
en presencia de un
poco de ácido
mineral, por lo
general ácido sulfúrico
concentrado o cloruro
de hidrógeno seco.
Esta reacción es
reversible y alcanza
el equilibrio cuando
aún quedan cantidades
apreciables de reactivos.
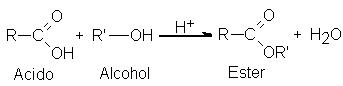
Por ejemplo,
si hacemos reaccionar
un mol de
ácido acético con
uno de alcohol
etílico en presencia
de un poco
de ácido sulfúrico
hasta alcanzar el
equilibrio (después de varias
horas), se tiene
una mezcla de
casi dos tercios
de mol de
éster y de
agua, y un
tercio de mol de ácido
y de alcohol.
Si comenzamos con
un mol de
éster y otro de
agua, obtenemos otra
vez esta misma
mezcla de equilibrio
en presencia de
ácido sulfúrico. El
mismo catalizador para
la reacción directa,
el ión hidrógeno,
también cataliza necesariamente la
reacción inversa, la
hidrólisis.
Esta reversibilidad es
un inconveniente en
la preparación directa
de un éster
a partir de
un acido; la preferencia por
la vía del
cloruro de ácido
se debe a que ambos
pasos, la preparación
del cloruro y
la del éster
con este último, son
esencialmente irreversibles y
llegan a la
terminación.
Sin embargo,
la esterificación directa
tiene la ventaja
de ser una
síntesis de un
solo paso. A
menudo resulta útil
si aplicamos nuestros
conocimientos de los
equilibrios. Si el
ácido el alcohol
son baratos y
de fácil adquisición,
se utilizan en
exceso para desplazar
el equilibrio hacia
la formación de
los productos y
aumentar así el
rendimiento en éster.
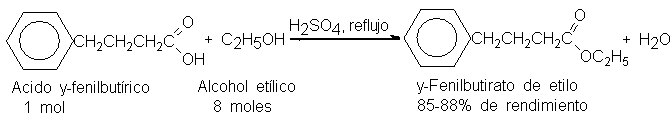
Por ejemplo, conviene
emplear ocho moles
del económico alcohol
etílico para convertir
un mol del
muy valioso ácido
y-fenibutírico más completamente
en el éster.
A veces,
el equilibrio se
desplaza por eliminación
de uno de
los productos. Una
buena forma de
lograrlo se ilustra
con la preparación
del adipato de
etilo. El ácido adípico,
un ácido dicarboxílato, se
calienta con alcohol
etílico en exceso,
tolueno y un
poco de ácido
sulfúrico bajo una
columna de destilación.
El componente más
volátil (p.e. 75ºC)
de la mezcla
en reacción es
un azeótropo formado
por agua, alcohol
etílico y tolueno (compárese
con Sec. 17.7).
En consecuencia, con
la misma velocidad
con que se
forma, el agua
se la elimina
por destilación azeotrópica.
De este modo
se obtiene un
rendimiento de éster
del 95 al
97%:
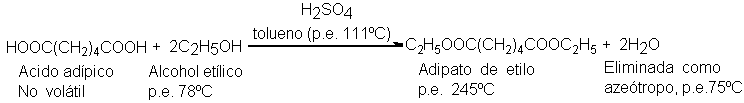
El equilibrio
es particularmente desfavorable
si utilizamos fenoles
(ArOH) en lugar
de alcoholes. No
obstante, si se
elimina agua durante
la reacción, obtenemos
ésteres fenílicos (RCOOAr)
con rendimientos importantes.
La presencia
de grupos voluminosos
próximos al lugar
de la reacción,
en el alcohol o
en el ácido,
disminuye la velocidad
de la esterificación (y
la de la
reacción inversa la
hidrólisis). El impedimento
estérico puede ser
tan marcado que
se necesitan métodos
especiales para
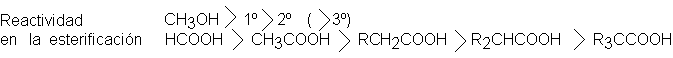
Preparar ésteres
de alcoholes terciarios
de ácidos, como
2,4,6-trimetilbenzoico
(ácido mesitoico).
El mecanismo
de la esterificación es, necesariamente, el
inverso exacto del de la
hidrólisis de ésteres.
Veremos ambos cuando
tratemos la química
de los ésteres,
después de haber
estudiado algo más
sobre el grupo
carbonilo.