Página principal http://organica1.org
Efecto de
los sustituyentes sobre
la acidez
A continuación
veamos cómo afectan
a la acidez
los cambios en
la estructura del
grupo portador del
COOH. Todo factor
que estabilice más
al anión que
al ácido deben
incrementar la acidez,
y todo factor
que contribuya a
una menor estabilidad
del anión, debe
disminuirla. Por lo
dicho acerca de
los carbocationes, sabemos
lo que razonablemente podemos
esperar. Los sustituyentes
con atracción de
electrones dispersan la
carga negativa, estabilizan
al anión y
aumentan así la
acidez. Los sustituyentes
con liberación de
electrones, en cambio,
intensifican la carga
negativa, desestabilizan al
anión y entonces
reducen la acidez.
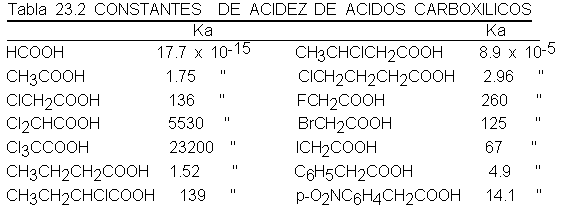
Los valores
de Ka de la
tabla 23.2 concuerdan
con este pronóstico.
Si observamos
primero los ácidos
alifáticos, notamos que
los halógenos que atraen
electrones fortalecen los
ácidos: el ácido
cloroacético es 100
veces más ácido
que el acético,
el dicloroacético es
aún más fuerte
y el tricloroacético es
más de 10 000 veces
más fuerte que el no
sustituido. Los otros
halógenos ejercen un
efecto similar.
El ácido
a-clorobutírico es casi
tan ácido como
el cloroacético. Sin
embargo, a medida
que el cloro
se aleja del
COOH, disminuye rápidamente
su efecto: el
ácido B-clorobutírico es
sólo seis veces
más ácido que
el butírico y y
el y-clorobutírico, lo es el
doble. Es típico
que los efectos
inductivos decrezcan con la distancia,
y raramente son
importantes cuando actúan
a través de
más de cuatro
átomos.

![]()
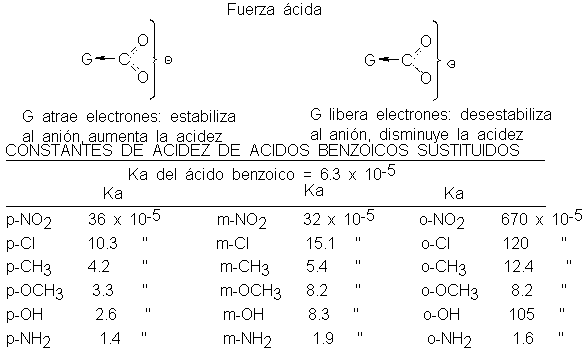
Los ácidos aromáticos son
afectados de forma
similar por los
sustituyentes: CH3, -OH y –NH2
debilitan al ácido
benzoico, mientras que
-CI y -NO2
lo hacen más
fuerte. Reconocemos los
grupos que disminuyen
la acidez como
aquellos que activan
el anillo hacia
las sustituciones electrofílicas (y
lo desactivan hacia
las nucleofílcas). Los
grupos que aumentan
la acidez son
los que se
desactivan hacia la
sustitución electrofílica (y
se activan hacia
la nucleofílica). Además,
los grupos que
ejercen mayores efectos
sobre la reactividad,
activando o desactivando,
también los tienen
sobre la acidez.
Los grupos
-OH y -CH3
ejercen los dos
tipos de efecto
que les hemos
atribuido: desde la
posición meta, un
efecto atractivo de
electrones que acentúa
la acidez inductivamente; y
desde la posición
para un efecto
de resonancia, liberador
de electrones, que
debilita la acidez
( el cual
es más fuerte
que el inductivo
en esta posición).
Compárese con los
dos efectos ejercidos
por los halógenos.
Los ácidos
aromáticos orto-sustituidos no tienen
cabida en la
norma establecida por
sus isómeros meta y
para, y por
los ácidos alifáticos.
Casi todos los
sustituyentes orto ejercen
un efecto del
mismo tipo acentúan
la acidez, atraigan
liberen electrones. Este
efecto es excepcionalmente intenso.
(Por ejemplo, compárense
los efectos de
-NH2 y -CH3,
de -N2 y
m- p-N2.) Este
efecto orto, sin
duda, tiene que
ver con la
cercanía de los
grupos implicados, pero
es algo más
que el simple
impedimento estérico que
surge de sus
tamaños.
De este
modo, vemos que
los mismos conceptos
efectos inductivos y de resonancia -,
tan útiles en el estudio
de la velocidad
de reacciones, pueden
aplicarse a los
equilibrios. Al utilizar
estos conceptos para
estimar las estabilidades
de aniones, estamos
en condiciones de
anticipar las fuerzas
relativas de los
ácidos; así, no
sólo podemos explicar
el efecto de
los sustituyentes sobre
la fuerza de
ácidos carboxílicos, sino
también el hecho
mismo de que
estos compuestos sean
ácidos.