Página principal http://organica1.org
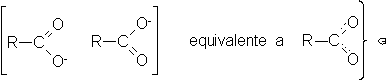
Estructura de
iones carboxilato
Entonces, de
acuerdo con la
teoría de la
resonancia el ión
carboxilato resulta ser
un híbrido de
dos estructuras que
contribuyen por igual,
por ser de
la misma estabilidad.
El carbono se encuentra
unido a cada
oxígeno por uno
y medio enlaces.
La carga negativa
está distribuida uniformemente
sobre los dos átomos
de oxígeno.
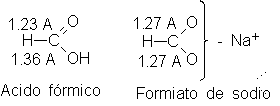
Las longitudes
de los enlaces
confirman que el
anión es realmente
un híbrido de
resonancia. El ácido
fórmico, por ejemplo,
contiene un doble
enlace carbono-oxígeno y
otro simple, y
es de suponer
que ambos son
de longitud diferente.
Por otra parte,
el formiato de
sodio es un
híbrido de resonancia,
por lo que
deberá tener dos
enlaces carbono-oxígeno equivalentes
de igual longitud,
intermedia entre dobles
y simples enlaces.
La difracción con
rayos X y
electrónica indican que
estas espectativas son
correctas. El ácido
fórmico tiene un
enlace carbón-oxígeno de
1.36 A (simple)
y otro de
1.23 A (doble);
el formiato de
sodio contiene dos
enlaces carbono-oxígeno iguales,
cada uno de
1.27 A.
¿Qué significa
esta resonancia para
los orbitales? El
carbón carboxílico se
encuentra unido a
otros tres átomos
mediante enlaces o (Fg. 23.4);
como éstos utilizan
orbitales sp2 , se
hallan en un plano
separados 120º. El
orbital p sobrante
del carbono solapa
igualmente bien a
los orbitales p
de ambos oxígenos
para formar enlaces
híbridos. De este
modo, los electrones
no sólo se
unen a uno
o dos núcleos,
sino a tres (
un carbono y
dos oxígenos), por
lo que están
retenidos más firmemente;
los enlaces son
más fuertes, y
el anión, más
estable. Esta participación
de electrones en
más de un
enlace esta delocalización de
la nube electrónica,
se representa mediante
un híbrido de
resonancia de dos estructuras.
