Página principal http://organica1.org
Ionización
de los
ácidos carboxílicos. Constante
de acidez
En solución
acuosa, un ácido
carboxílico existe en
equilibrio con el
anión carboxilato y el
ión hidrógeno (de
hecho, el ión
hidronio, H3O+).
![]()
Como para todo equilibrio, las concentraciones de los componentes se relacionan mediante la expresión
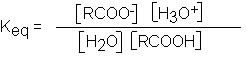
Puesto que
la concentración del disolvente,
el agua, permanece
esencialmente constante puede
combinarse con Keq para
obtener la expresión.
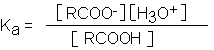
En la
que Ka es
igual a Keq H2O
y la nueva
constante Ka se
denomina constante de
acidez.
Cada ácido
carboxílico tiene su Ka característica, que
indica lo fuerte
que es. Puesto
que la acidez
es la razón
entre el material
ionizado y el no
ionizado, cuanto mayor
sea Ka , mayor
será la ionización (en un
conjunto determinado de
condiciones), y más
fuerte será el
ácido.
Así pues,
utilizamos las Ka para
comparar con precisión
las fuerzas de
ácidos diferentes.
En la
tabla 23.2 se muestra
que los ácidos
alifáticos y aromáticos
no sustituidos tienen
Ka del orden
de 10-4 a
10-5 (0.000 01); esto
significa que sólo
son débilmente ácidos,
con sólo una leve tendencia
a liberar protones.
Por la
misma razón, los
aniones carboxilato son
moderadamente básicos, con
una tendencia considerable
a la combinación con protones.
Reaccionan con agua para
aumentar la concentración de ión hidróxido, reacción
que a menudo
se denomina hidrólisis.
Como
![]()
Consecuencia, las
soluciones acuosas de
sales de ácidos
carboxílicos son ligeramente
alcalinas. (La basicidad
de una solución acuosa de
un carboxilato se
debe sobre todo a
estos aniones, no a los
relativamente pocos iones
hidróxido que se
generan.)
Podemos ahora
ampliar la secuencia
de acidez y
basicidad relativas:
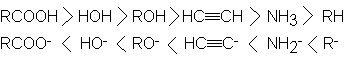
Ciertos ácidos
sustituidos son mucho
más fuertes o
más débiles que
un ácido típico
como el CH3COOH. Veremos
que puede explicarse
razonablemente el efecto
intensificador o debilitador
de la acidez
que ejerce un
sustituyente determinado. Sin
embargo, hay que
saber antes algo
más sobre el
equilibrio en general.