Aromaticidad
Benceno
(Ir a página principal http://organica1.org/ )
1 Compuestos alifáticos y aromáticos
3 Fórmula molecular. Número de isómeros.
4 Estabilidad del anillo bencénico.
Reacciones del benceno
5 Estabilidad del anillo bencénico.
6 Longitudes de los enlaces carbono-carbono
del benceno
7 Estructura resonante del benceno
8 Descripción orbital del benceno
9 Representación del anillo bencénico
10 Carácter aromático. La regla 4n + 2 de Hückel
11 Nomenclatura de los derivados del benceno
12 Análisis elemental cuantitativo: nitrógeno
y azufre
1
Compuestos alifáticos y aromáticos
Los químicos han
considerado útil dividir todos los compuestos orgánicos en dos grandes clases:
compuestos alifáticos y compuestos aromáticos. Los significados originales de las
palabras alifático (graso) y aromático
(fragante) han dejado de tener sentido.
Los compuestos alifáticos
son los de cadena abierta y los cíclicos que se les asemejan. A excepción de la
aparición ocasional de un grupo fenilo (C6H5), las partes
de hidrocarburo de los compuestos estudiados hasta ahora han sido alifáticas.
Los compuestos aromáticos
son el benceno y los compuestos de comportamiento químico similar. Las
propiedades aromáticas son las que distinguen al benceno de los
hidrocarburos alifáticos. La molécula
bencénica es un anillo de un tipo muy especial. Hay ciertos compuestos también
anulares que parecen diferir estructuralmente del benceno y sin embargo se
comportan de forma similar. Resulta que estos otros compuestos se parecen
estructuralmente al benceno en su estructura electrónica básica, por lo que
también son aromáticos.
Los hidrocarburos
alifáticos alcanos, alquenos, alquinos y sus análogos cíclicos reaccionan
principalmente por adición y sustitución por radicales libres: la primera ocurre
en los enlaces múltiples; la segunda, en otros puntos de la cadena alifática.
Vimos que estas mismas reacciones suceden en las partes hidrocarbonadas de
otros grupos funcionales, y la reactividad de estos últimos, por la presencia
de la parte de hidrocarburo.
En cambio, veremos que los
hidrocarburos aromáticos se caracterizan por su tendencia a la sustitución
heterolítica. Además, estas mismas reacciones de sustitución son
características de anillos aromáticos dondequiera que aparezcan, independientemente de los otros grupos funcionales que
la molécula pudiera contener. Estos últimos afectan a la reactividad de los
anillos aromáticos, y viceversa.
En este capítulo
examinaremos la cualidad fundamental de la aromaticidad: cómo difieren en
comportamiento lso compuestos aromáticos de los alifáticos, y qué hay en sus
estructuras que los hace diferentes. Después
veremos cómo se realizan estas reacciones aromáticas características, y
cómo se ven afectadas por los sustituyentes que se encuentran en el anillo
aromático. Posteriormente tomaremos un punto de vista opuesto y analizaremos
los notables efectos que ejercen los anillos aromáticos, actuando como sustituyentes, sobre
reacciones que ocurren en otras partes de la molécula.
En el resto del libro
actuaremos como químicos orgánicos y examinaremos las moléculas alifáticas y
aromáticas según aparezcan, o, como
sucede corrientemente, las dos moléculas, alifáticas y aromáticas. Es
importante no atribuir un valor excesivo a la división entre sustancias
alifáticas y aromáticas. Aunque es muy útil, a menudo es menos importante que
otras clasificaciones. Las similitudes entre ácidos alifáticos y aromáticos,
por ejemplo, o entre aminas alifáticas y aromáticas, son más importantes que
las diferencias.
2
Estructura del benceno
Por nuestra definición de
los compuestos aromáticos es evidente que todo estudio de su química debe
comenzar con un análisis del benceno. El benceno se conoce desde 1825, y sus
propiedades químicas y físicas son mejor conocidas que las de ningún otro
compuesto orgánico. A pesar de ello, hasta el año 1931 no se había logrado
proponer una estructura satisfactoria para esta sustancia, y tuvieron que pasar
de 10 a 15 años para que fuera de uso general entre los químicos orgánicos.
La dificultad no residía en
la complejidad de la molécula, sino más bien en las limitaciones del desarrollo
que había alcanzado por entonces la teoría estructural. Puesto que es importante comprender la
estructura del benceno para estudiar compuestos aromáticos y ampliar nuestros
conocimientos sobre la teoría estructural, examinaremos con algún detalle los
hechos en que se basa.
3
Fórmula molecular. Número de isómeros.
Estructura de Kekulé
El benceno tiene la fórmula
molecular C6H6. Por su composición elemental y peso
molecular, se sabía que el benceno tiene seis carbonos y seis átomos de
hidrógeno. El problema era conocer la disposición de esos átomos.
En 1858, August Kekulé
(Unioversidad de Bonn) propuso que los átomos de carbono se pueden unir entre
sí para formar cadenas carbonadas a veces pueden ser cerradas, para formar
anillos. Como describió más tarde:
<<Estaba sentado,
escribiendo mi libro, pro el trabajo no progresaba. Mis pensamientos estaba
lejos. Moví la silla hacia el fuego y dormité. Los átomos nuevamente
brincaban ante mis ojos. Esta vez, los
grupos más pequeños se mantenían modestamente al fondo. Mi ojo mental,
agudizado por las repetidas visiones de este tipo, podía ahora distinguir
estructuras mayores de muchas conformaciones: largas filas, a veces apretadas,
girando y rotorciéndose como serpientes. Pero, ¿qué fue eso? Una de las
serpientes había logrado asir su propia cola y la figura danzaba burlonamente
ante mis ojos. Desperté como por el destello de un relámpago;... pasé el resto
de la noche desarrollando las
consecuencias de la hipótesis. Señores, aprendamos la verdad.>>
-August Kekulé, 1980.
Actualmente
representaríamos la estructura bencénica de Kekulé como I.
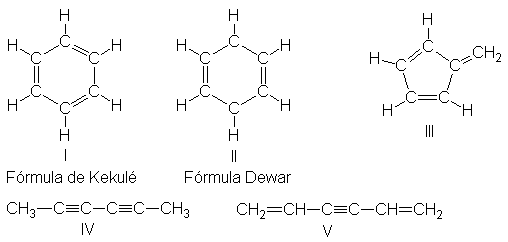
Por supuesto, hay otras fórmulas
que se ajustan a la fórmula C6H6, como II-V, por ejemplo.
De todas ellas, la estructura de Kekulé se aceptó casi como la más
satisfactoria. La evidencia era de un tipo que ya resulta conocido: el número
de isómeros .
(a) El benceno sólo da un producto monosustituido,
C6H5Y. Cuando se reemplaza un átomo de hidrógeno por
bromo, sólo se obtiene un bromobenceno, C6H5Br;
análogamente, también se obtiene un clorobenceno, C6H5Cl,
o un nitrobenceno, C6H5NO2, etc. Este hecho
impone una severa limitación a la
estructura del benceno: todos sus hidrógenos deben ser exactamente
equivalentes. El reemplazo de cualquiera de ellos da el mismo producto.
Así, por ejemplo, la
estructura V debe descartarse, ya que daría dos derivados monobromados
isómeros, los compuestos 1- y 2-bromados; no todos los hidrógenos de V son equivalentes. Un razonamiento similar nos
permite deducir que II y III tampoco sirven. (¿Cuántos productos
monosustituidos daría cada una de éstas?) Sin embargo, entrre otras, I y IV
seguen siendo posibilidades.
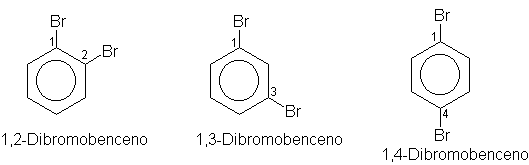
(b) El benceno da tres productos disustituidos
isómeros, C6H4Y2 o C6H4YZ.
Sólo existen tres dibromobencenos isómeros, C6H4Br2,
tres cloronitrobencenos, C6H4CINO2, etc. Este
hecho limita aún más las posibilidades estructurales. Por ejemplo, ahora debe
rechazarse IV. (¿Cuántos productos disustituidos daría IV?)
A primera vista, la estructura I parece congruente con este nuevo hecho. Es decir, podemos esperar los tres derivados dibromados isómeros, 1,2-, 1,3- y 1,4-, que se ilustran a continuación:

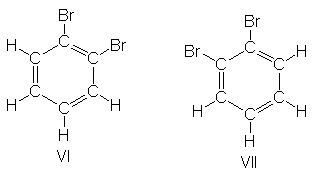
Sin embargo, un examen más
detenido de la estructura I demuestra que serían posibles dos isómeros
1,2-dibromados (VI y VII), que difieren en las posiciones del bromo en relación
con los dobles enlaces:
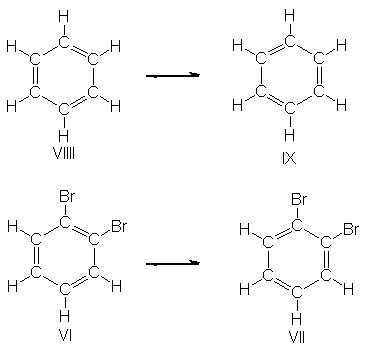
No obstante, Kekulé imaginó
la molécula bencénica como algo dinámico: <<...la figura danzaba
burlonamente ante mis ojos...>> La describió en función de dos
estructuras, VIII y IX, entre las que alternaba la molécula del benceno. Como
consecuencia, los dos 1,2-dibromobencenos (VI y VII) estarían en un equilibrio
rápido, por lo que serían inseparables.
Más tarde, cuando quedó
definida la idea de la tautomería, se asumió que la <<alternación>>
de Kekulé era esencialmente una tautomería.
Por otra parte, algunos
creen que Kekulé se anticipó intuitivamente a nuestro concepto moderno de los
electrones deslocalizados en unos 75 años, y dibujó dos estructuras (VII y IX)
–como lo haremos también nosotros a modo de una representación aproximada de
algo que ninguna de las estructuras por sí sola representa satisfactoriamente.
Bien o mal, el término <<estructural de Kekulé>>ha llegado a
significar una molécula (hipotética) con enalces dobles y simples alternados,
lo mismo que el <<benceno Dewar>>, que James Dewar diseño en 1867
como ejemplo de lo que el benceno no era, ha llegado a representar una
estructura (II).
4
Estabilidad del anillo bencénico. Reacciones del benceno
La estructura de Kekulé
explica satisfactoriamente los hechos (a), (b) y (c) de la sección 13.3. Hay,
sin embargo, varios hechos que todavía no quedan aclarados con esa estructura:
la mayoría de estos aparentemente se relacionan con la

estabilidad inusual del
anillo bencénico. La prueba más sorprendente de esta estabilidad son las
reacciones químicas del benceno.
(c) El benceno experimenta reacciones de
sustitución, más que de adición. La estructura bencénica de Kekulé corresponde
a una que llamaríamos <<ciclohexatrieno>>. Por esto, debería
reaccionar con facilidad por adición, como lo hacen los compuestos similares,
ciclohexadieno y ciclohexeno, que es una característica de la estructura de los
alquenos. Pero ese no es el caso, como lo demuestran los ejemplos de la tabla 13.1. En condiciones donde los alquenos
reaccionan rápidamente, el benceno no reacciona, o sólo lo hace muy lentamente.
En lugar de las reacciones
de adición, el benceno experimenta con facilidad un conjunto de reacciones, todas
de sustitución. A continuación, indicaremos las más importantes.

En cada una de estas
reacciones se ha sustituido un átomo, o grupo, por uno de los átomos de
hidrógeno del benceno. A su vez, el producto
puede sufrir sustitución posterior del mismo tipo. El hecho de que haya
retenido las propiedades características del benceno indica que ha mantenido también su estructura
característica.
Es evidente que el benceno
resiste la adición, que destruiría su sistema anular, en cambio, se sustituye
con facilidad, conservando el sistema anular.
5
Estabilidad del anillo bencénico.
Calores de hidrogenación y de combustión
Además de las indicaciones
cualitativas anteriores de que el anillo bencénico es más estable de lo que
cabe esperar del ciclohexatrieno, existen
datos cuantitativos que muestra cuánto es más estable.
(d) Los calores de hidrogenación y combustión del
benceno son menores de lo esperado. Recordemos que el calor de hidrogenación es la cantidad de calor desprendida,
cuando se hidrogena un mol de un compuestoo no saturado. En la mayoría de los
casos, es de 28-30 kcal por cada doble enlace que contenga la sustancia. No es
de extrañar, por tanto, que el ciclohexeno tenga un calor de hidrogenación de
28.6 kcal y que el del ciclohexadieno sea aproximadamente el doble (55.4 kcal).
Podríamos suponer,
razonablemente, que el ciclohexatrieno tiene un calor de hidrogenación unas
tres veces mayor que el ciclohexeno (85.8 kcal). En realidad, el valor para el
benceno (49.8 kcal) es 36 kcal menor que el valor supuesto.
Quizá pueda expresarse
mejor lo expuesto por medio de un diagrama de energía (Figura 13.1), donde la
altura de una línea horizontal representa el
contenido de energía potencial de una molécula. Las líneas discontinuas
representan los valores esperados, basados en tres tramos iguales de 28.6 kcal.
En los tres casos, el producto final es el ciclohexano.
El hecho de que el benceno
libere 36 kcal menos que lo calculado sólo puede significar que contiene 36
kcal menos que lo predicho. En otras palabras, el benceno tiene una estabilidad
36 kcal mayor que la prevista para el ciclohexatrieno. El calor de combustión
del benceno también es menor en aproximadamente la misma cantidad que el
estimado.
6
Longitudes de los enlaces carbono-carbono del benceno
(e) Todos los enlaces carbono-carbono del benceno
son iguales y de una longitud intermedia
entre enlaces simples y dobles. Los dobles enlaces carbono-carbono son
de aproximadamente 1.34 A en una gran variedad de compuestos; los simples,
donde los núcleos permanecen unidos por un solo par de electrones, son
considerablemente más largos: 1.53 A en el etano, por ejemplo, 1.50 A en el
propileno, 1.48 A en el 1,3-butadieno.
Si el benceno realmente
tuviera tres enlaces simples y tres dobles, como en la estructura de Kekulé,
sería de esperar que hubiera t tres enlaces cortos (1.34 A) y tres largos
(probablemente 1.48 A, como en 1,3-butadieno). Sin embargo, los estudios de
difracción por rayos X indican que los seis enlaces carbono-carbono del benceno
son iguales y con una longitud de 1.39 A, por lo que son intermediarios entre
simples y dobles.
7
Estructura resonante del benceno
Aunque evidentemente no
satisfactoria, la estructura del benceno propuesta por Kekulé se usó de forma
generalizada hasta 1945. La estructura
aceptada actualmente no es resultado de nuevos descubrimientos sobre el
benceno, sino que es la consecuencia de una ampliación o modificación de la
teoría estructural, que corresponde al concepto de resonancia.
Las estructuras de Kekulé I
y II satisfacen las condciiones para la resonancia, como podemos apreciar de
inmediato: son estructuras que sólo difieren en la disposición de los
electrones. El benceno es un híbrido de I y II. Puesto que I y II son
exactamente equivalentes, y por tanto de giual estabilidad, contribuyen por
igual al híbrido, y al ser exactamente equivalentes, la estabilización debida a
la resonancia debe ser grande.
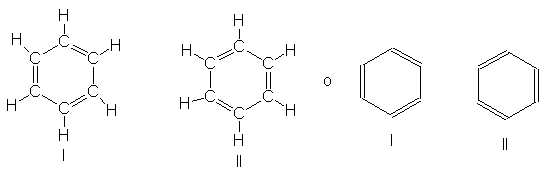
Lo desconcertante de las
propiedades del benceno queda ahora aclarado. Las seis longitudes de enalce son
iguales, porque las seis uniones son idénticas: de hecho, un enlace y medio
cada uno, y su longitud 1.39 A, es intermedia entre la longitud de un enalce
simple y la de uno doble.
Al reconocer que todos los
enlaces carbono-carbono del benceno son equivalentes, desaparecen la dificultad
para justificar el número de productos
disustituidos isómeros: es evidente que sólo debe haber tres, de acuerdo con
las pruebas experimentales.
Finalmente, la
estabilidad <<excepcional>>
del benceno no tiene nada de excepcional: es la que se espera de un híbrido de
estructuras equivalentes. Las 36 kcal de energía que el benceno no contiene
comparado con el ciclohexatrieno es energía de resonancia. Estas 36 kcal de
energía de estabilización de resonancia son las responsables del conjunto de
propiedades nuevas que llamamos propiedades aromáticas.
Las reacciones de adición
convierten un alqueno en un compuesto saturado más estable. Por ejemplo, la
hdirogenación del cicloehxeno va acompañada de la evolución de 28.6 kcal, y
significa que el producto se encuentra 28.6 kcal más bajo en la escala
energética que los reactivos (Fig.
13.1).
Sin embargo, la adición
convertiría al benceno en un producto menos estable, por destrucción del
sistema anular bencénico estabilizado por resonancia; por ejemplo, de acuerdo
con la figura 13.1, la primera etapa de la hidrogenación del benceno requiere
5.6 kcal para convertirlo en el menos estable ciclohexadieno. Como
consecuencia, resulta mucho más fácil para las reacciones del benceno seguir un
curso enteramente diferente, uno en el que se mantiene el sistema anular: la
sustitución.
(Esto no es todo con
respecto a la estabilidad. Como veremos en Sec. 10), se necesita un factor
adicional, aparte de la resonancia, para hacer del benceno lo que es.)
8
Descripción orbital del benceno
Si se toman en
consideración sus orbitales de enlace, se logra una descripción más detallada
de la molécula del benceno.
Como cada carbono está
enlazado a tres átomos, utiliza orbitales sp2 (como en el etileno),
que se encuentran en un mismo plano, el del núcleo del carbono, y se dirigen
hacia los vértices de un triángulo equilátero. Si disponemos seis carbonos y
seis hidrógenos de modo que se permita el solapamiento máximo de estos
orbitales, obtenemos la estructura ilustrada en la figura 13.2ª.
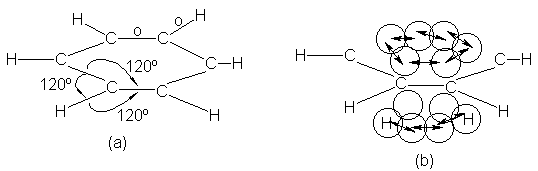
El benceno es una molécula
plana, con todos los carbonos e hidrógenos ubicados en el mismo plano. Además,
es una molécula muy simétrica, con todos los carbonos en los vértices de un
hexágono regular. Cada ángulo de enlace mide 120º. Cada orbital de enlace es
cilíndricamente simétrico alrededor de la línea de unión de los núcleos atómicos,
por lo que estas uniones se designan como enlaces o.
Sin embargo, la molécula
todavía no está completa: aún quedan sin ubicar seis electrones. Aparte de los tres orbitales ya empleados, cada átomo
de carbono aún dispone de un cuatro orbital p, que tiene,como sabemos, dos
lóbulos: uno encima y el otro debajo del plano de los tres orbitales restantes;
o sea, encima y debajo del plano del anillo. Ese orbital está ocupado por un
solo electrón.
Como en el etileno, el
orbital p de un carbono puede solapar al correspondiente de un carbono
adyacente, lo que permite el apareamiento de los electrones y la formación de
un enlace n adicional (véase Fig. 13.2b). Pero aquí el solapamiento no queda
limitado a un par de orbitales p, como en el etileno: el orbital p de cualquiera
de los carbonos solapa igualmente bien a los orbitales de ambos carbonos unidos
a él. El resultado (véase Fig. 13.3) son dos nubes electrónicas n continuas con
forma de rosca, una encima y la otra debajo del plano de los átomos.
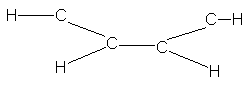
Como en el radical alilo,
el solapamiento de los orbitales p en ambas direcciones y la participación
resultante de cada electrón en varios enlaces es lo que corresponde a nuestra
descripción de la molécula como un híbrido de resonancia de dos estructuras.
Nuevamente, la deslocalización de los electrones su participación en varios
enlaces es la que estabiliza la molécula.
Para acomodar seis
electrones n, debe haber tres orbitales. No obstante, la suma de ellos
corresponde a las nubes n simétricas descritas.
La descripción orbitales
revela la importancia de la planaridad del anillo bencénico. El anillo es
plano porque lso ángulos trigonales (sp2)
de los enlaces del carbono se ajustan exactamente a los ángulos de 120º de un
hexágono regular. Esta planaridad permite el solapamiento de los orbitales p en
ambas direcciones, con la deslocalización y estabilización resultante.
Los hechos concuerdan con
esta descripción orbital del benceno. La difracción por rayos X y la
electrónica indican que el benceno (Fig. 13.4) es una molécula completamente
plana y simétrica, con todos los enalces carbono-carbono iguales y todos los
ángulos de enlace de 120º. (Véase Fig. 13.5)
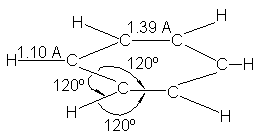
Veremos que las propiedades del benceno son justamente
las que corresponden a esta estructura.
A pesar de la deslocalización, los electrones n están más sueltos que los o.
Por tanto, los electrones n están especialmente disponibles para un reactivo
que busca electrones. Las reacciones típicas del anillo bencénico son aquellas
en las que el anillo sirve de fuente electrónica para reactivos electrofílicos
(ácidos). Debido a la estabilización por resonancia del anillo bencénico, esas
reacciones llevan a la sustitución, en el cual se conserva el carácter
aromático del anillo bencénico.
9
Representación del anillo bencénico
Por razones prácticas,
representaremos el anillo bencénico por medio de un hexágono regular con un
círculo inscrito (l). Se entiende que hay un hidrógeno unido a cada ángulo del
hexágono, salvo que se indique otro átomo o grupo.
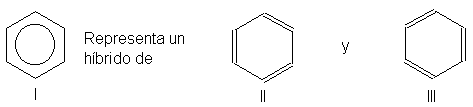
I representa un híbrido de
resonancia de las estructuras de Kekulé II y III. Las líneas rectas denotan
enlaces o que unen átomos de carbono. El círculo simboliza la nube de seis
electrones n deslocalizados. (Desde otro punto de vista, las líneas rectas
representan enlaces simples, y el círculo, los semienlaces adicionales.)
Esta es una representación
especialmente útil del benceno, puesto que pone de manifiesto la equivalencia
de los diversos enlaces carbono-carbono. La presencia del círculo distingue al
anillo del benceno del anillo del ciclohexano, pues éste se suele representar por un simple hexágono.
Entre los químicos no hay
acuerdo total sobre cómo representar el anillo bencénico. El estudiante lo
verá, con frecuencia, como una de las fórmulas de Kekulé. La representación
adoptada en este libro tiene ciertas ventajas, y uso parece estar ganando
terreno. Es interesante destacar que prácticamente la misma representación fue
propuesta en 1899 por Johannes Thiele (Universidad de Munich), que empleaba un
círculo de puntos para simbolizar enlaces parciales (<<valencias
parciales >>).
10
Carácter aromático. La regla 4n + 2 de Hückel
Hemos definido los compuestos aromáticos como aquellos que son
semejantes al benceno. Sin embargo, ¿Cuáles son las propiedades del benceno que
debe tener un compuesto para ser considerado aromático? Además de las
sustancias que contienen anillos bencénicos, hay muchas otras que se consideran
aromáticas, a pesar de que superficialmente casi no guardan semejanza con el
benceno.
¿Qué propiedades tienen en
común todos los compuestos aromáticos?
Desde el punto de vista
experimental, los compuestos aromáticos son sustancias cuyas fórmulas moleculares
hacen suponer un alto grado de insaturación, a pesar del cual son resistentes a
las reacciones de adición tan características de los compuestos no saturados.
En cambio, estos compuestos aromáticos a menudo sufren reacciones de
sustitución electrofílica similares a las del benceno. Junto con esta
resistencia a la adición y probablemente a causa de ella encontramos pruebas de
una estabilidad inusual, como bajos calores de hidrogenación y combustión. Las
sustancias aromáticas son cíclicas por lo general presentan anillos de cinco,
seis y siete átomos y su examen físico demuestra que tienen moléculas planas (o
casi planas). Sus protones tienen el mismo tipo de desplazamiento químico en
los espectros de RMN (Sec. 16.8) que en los del benceno y sus derivados.
Desde un punto de vista
teórico, para que una sustancia sea aromática, su molécula debe tener nubes
cíclicas de electrones n deslocalizados encima y debajo del plano de la
molécula; además, estas nubes n deben contener un total de (4n + 2) electrones
n, esto significa que no basta la deslocalización para que resulte la
estabilidad particular que caracteriza a un compuesto aromático. Debe haber un
número específico de electrones n: 2, 6 ó 10, etc. Este requisito, llamado
regla del 4n + 2 o regla de Hückel, se basa en la mecánica cuántica, y tiene
que ver con el llenado de los diversos
orbitales que conforman la nube n . Los hechos confirman claramente esta regla.
Veamos alguna evidencia
experimental que confirma esta regla. El benceno tiene seis electrones n, el
sexteto aromático. Por supuesto, el seis es
uno de los números de Hückel, que corresponde a n=1. Aparte del benceno y sus congéneres
(antraceno, fenantreno, naftaleno,), estudiaremos varios compuestos
heterocíclicos que son claramente
aromáticos, y son precisamente los que pueden proporcionar un sexteto
aromático.
Consideremos los seis
compuestos siguientes, para lo que sólo se ilustra una estructura
contribuyente:
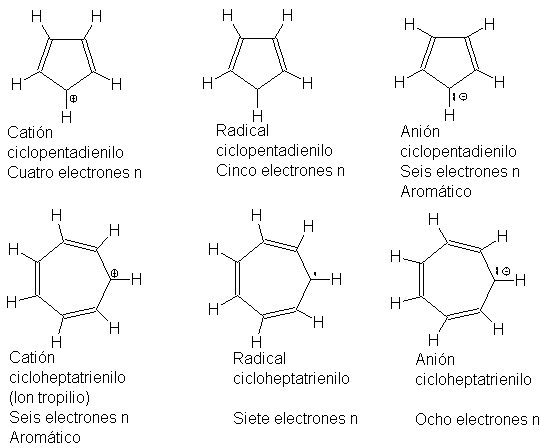
Cada molécula es un híbrido
de cinco o siete estructuras equivalentes con la carga o el electrón impar
sobre cada carbono. De los seis
compuestos, sin embargo, sólo dos dan muestra de una estabilidad excepcional:
el anión ciclopentadienilo y el catión cicloheptatrienilo (ion tropilio).
El ciclopentadieno es un
ácido extraordinariamente fuerte (Ka=10-15), para ser un hidrocarburo, lo que
indica que la pérdida de un ion hidrógeno genera un anión particularmente
estable. (Por ejemplo, es un ácido mucho más fuerte que el cicloheptatrieno,
Ka=10-45, aunque este último da un anión estabilizado por siete estructuras
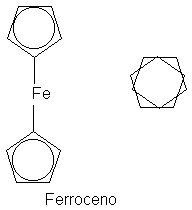
contribuyentes.) El diciclopentadienilohierro (ferroceno), (C5H5)- 2Fe++, es
una molécula estable queforma un emparedado con un átomo de hierro entre dos
anillos planos de cinco miembros. Todos los enlaces carbono-carbono son de 1.4
A. Los anillos del ferroceno pueden someterse a dos reacciones de sustitución
típicamente aromáticas: la sulfonación y la Friedel-Crafts.
De los derivados del ciloheptatrienilo,
por otra parte, el excepcional es el catión. El bromuro de tropilio, C7H7Br,
se funde a más de 200ºC, es soluble en agua, pero insoluble en disolventes no
polares, y da un precipitado inmediato de AgBr al ser tratado con nitrato de
plata. Este comportamiento es extraño para un bromuro orgánico, lo que indica
que estamos en presencia de un compuesto iónico, incluso en el estado sólido,
el R+Br-, cuyo catión efectivamente es un carbocatión estable.
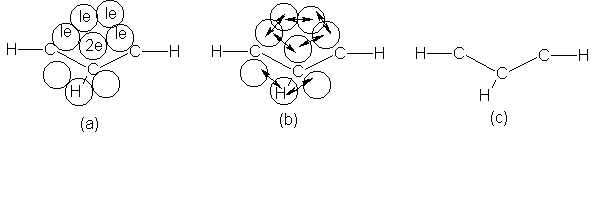
Consideremos la
configuración electrónica del anión ciclopentadieno (Fig. 13.6). Cada carbono,
hibridado trigonalmente, está unido a otros dos carbonos y a un hidrógeno por
un enlace o. El anillo es un pentágono regular, cuyos ángulos (108º) no son un
mal ajuste al ángulo trigonal de 120º; toda inestabilidad que resulte del
solapamiento imperfecto (tensión angular) queda ampliamente compensada por
ladeslocalización resultante. Cuatro carbonos tienen un electrón cada uno en
orbitales p; el quinto carbono (aquel que perdió el protón, pero que no puede
distinguirse de los demás) tiene dos electrones. El solapamiento de los
orbitales p da origen a las nubes n con
un total de seis electrones: el sexteto aromático. (Véase Fig. 13.7.)
En el ferroceno cada anión
ciclopentadienilo está unido al hierro por el solapamiento de la nube n con un
orbital vacío del metal. Se ha
desmotrado que este tipo de enlace existe entre compuestos con electrones n
alquenos, aromáticos y moléculas ácidas de muchos tipos: por ejemplo, iones
plata o halógenos. Tales complejos n se detectaron espectroscópicamente y
algunos se han aislado, como el ferroceno.
Se propuso que la formación
reversible de complejos n es el paso preliminar en la reacción de muchos
electrófilos con alquenos y compuestos
aromáticos.
El aislamiento del
ferroceno en 1951 despertó gran interés, no sólo por ser un ejemplo de
compuesto aromático no bencenoide concordante con la regla de Hückel; lo más
importante fue que la fuerza de este enlace n revolucionó el campo de los
complejos orgánicos de los metales de transición una revolución que dio a los químicos orgánicos unos catalizadores
de una selectividad y poder sin precedentes.
De forma similar, llegamos
a la configuración del ion tropilo, que es un heptágono regular (ángulos de 128.5º).
Cada uno de los seis átomos de carbono contribuye con un electrón p, y el
séptimo sólo colabora con un orbital p vacío. El resultado es el sexteto
aromático.
Estos iones se representan
convenientemente como sigue:
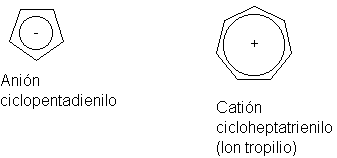
Por una buena razón, el
número de Hückel más común es seis. Para proporcionar orbitales p, los átomos
del anillo aromático deben estar hidridados trigonalmente (sp2), que
idealmente significan ángulos de enlace de 120º. Para permitir el solapamiento
de estos orbitales que generan la nube n, el compuesto aromático debe ser plano o casi plano. El número de átomos
hibridados trigonalmente que puede acomodarse en un anillo plano, sin tensión
angular excesiva ( es decir, con un solapamiento razonablemente bueno para
formar enlaces n) es cinco, seis o
siete. Como apreciamos en los ejemplos, seis es el número de Hückel de
electrones n que estos átomos pueden proporcionar. El benceno, como vimos, es
la muestra perfecta: los seis carbonos proporcionan seis electrones n y forman
un hexágono con ángulos trigonales perfectos.)
¿Qué pruebas indican que
otros números de Hückel –2, 10, 14, etc. también son números mágicos? En tales
casos, no podemos esperar que el carácter aromático se manifieste en forma de
compuestos de gran estabilidad, comparables al benceno y sus derivados. Los
anillos serán demasiado pequeños o muy grandes para acomodar adecuadamente
átomos con hibridación trigonal, de modo que toda estabilización angular o un
solapamiento insuficiente de orbitales p, o por ambas causas.
Debemos investigar la
estabilidad basándonos en la comparación tal como se hizo con los derivados del
ciclopentadienilo y cicloheptatrienilo y encontrar pruebas de aromaticidad en
el hecho de que una especie molecular es menos inestable que sus semejantes.
El resultado final de gran
cantidad de trabajo cuidadoso da firme
apoyo a la regla de 4n + 2.
La pregunta es ahora: ¿por
encima dequé combinación desfavorable de tensión angular y carga múltiple puede
manifestarse la aromaticidad?
11
Nomenclatura de los derivados del
benceno
En capítulos posteriores
consideraremos en detalle la química de muchos de los derivados del benceno.
Sin embargo, es útil aprender a nombrar algunos de estos derivados más
importantes, que servirán para nuestro estudio actual de las reacciones del
anillo bencénico. En el caso de muchos deestos derivados, basta con anteponer
el nombre del grupo sustituyente a la
palabra benceno, como, por ejemplo, clorobenceno, bromobenceno, yodobenceno o
nitrobenceno. Otros derivados tienen nombres especiales que pueden carecer de
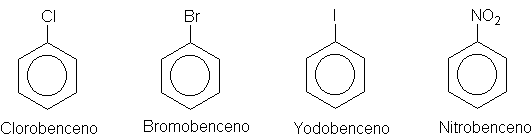
Semejanza con el nombre del
grupo sustituyente. Por ejemplo, el metilbenceno sólo se conoce como tolueno;
el aminobenceno, como anilina; el hidroxibenceno, como fenol, etc. Los
compuestos especiales más importantes son:
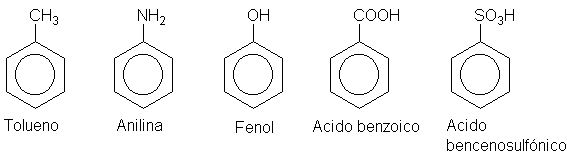
Si existen varios grupos
unidos al anillo bencénico, no sólo es necesario identificar cuáles son, sino
también indicar su ubicación relativa. Los tres isómeros posibles para bencenos
disustituidos se caracterizan por los prefijos orto, meta y para, abreviados
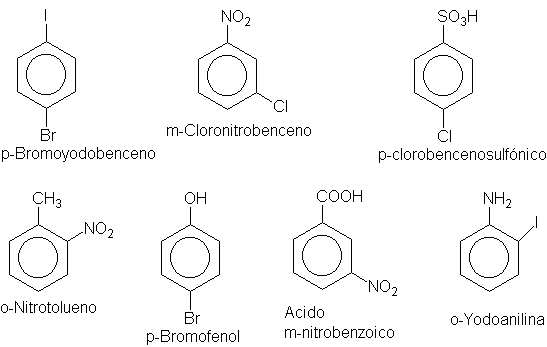
o-, m- y p Por ejemplo:
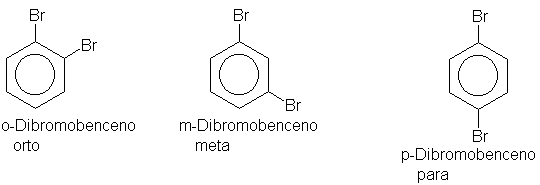
Si los dos grupos son
diferentes, y ninguno de ellos confiere un
nombre especial a la molécula, los nombramos sucesivamente y terminamos
la palabra con benceno; por ejemplo, cloronitrobenceno, bromoyodobenceno, etc.
Si uno de los dos grupos es del tipo que da a la molécula un nombre especial,
el compuesto se denomina como un derivado de aquella sustancia especial. Por
ejemplo, nitrotolueno, bromofenol, etc.
Si el anillo bencénico
tiene unidos más de dos grupos, se utilizan números para indicar sus posiciones
relativas. Por ejemplo:

Si todos los grupos son iguales,
se asigna a cada uno de ellos un número, siendo la secuencia la que da la
combinación de números más bajos; si los grupos son diferentes, se
sobreentiende que el último nombrado se encuentra en la posición 1 y que los demás números se
refieren a éste. Por ejemplo, 3- bromo-5-cloronitrobenceno. Si está presente
uno de los grupos que dan denominación especial, el compuesto se nombra con
dicho grupo en la posición 1. Así, en el 2,6-dinitrotolueno se considera que el
grupo metil está en la posición 1.
12
Análisis elemental cuantitativo: nitrógeno y azufre
En este capítulo se
trataron la estructura del benceno y algunas de sus reacciones. Una vez más,
vale la pena recordar que todo este análisis tiene sentido porque se basa en
hechos concretos. Como vimos anteriormente, sólo podemos estudiar la estructura
y las reacciones de un compuesto si conocemos su fórmula molecular y las de sus
productos.
Para conocer una fórmula molecular
debemos saber qué elementos constituyen la sustancia y en qué proporciones se
encuentra.
Para el nitrógeno, el
análisis cuantitativo se realiza (a) por el método de Dumas o (b) por el método
de Kjeldahl. Este último es más apropiado, en particular si es necesario
efectuar varios análisis. No es aplicable, sin embargo, a todos los tipos de
compuestos nitrogenados.
En el método de Dumas, la sustancia orgánica se hace
pasar por un tubo que contiene, primero, óxido cúprico oxida el compuesto (como
en la combustión carbono-hidrógeno, Sec. 2.27), conviertiendo el nitrógeno combinado
en molecular. La malla de cobre reduce los óxidos del nitrógeno que pudieran
haberse formado a nitrógeno elemental, que se recoge y se mide su volumen. Por
ejemplo, una muestra de anilina de 8.32 mg da e.11 ml de nitrógeno a 21ºC y una
presión de 743 mm (corregida con respecto a la presión de vapor del agua).
Calculamos el volumen a temperatura y presión normales.
![]()
Y de aquí, el peso del
nitrógeno,
![]()
Y, finalmente el procentaje
de nitrógeno de la muestra
![]()
En el método de Kjeldahl,
se digiere el compuesto orgánico con ácido sulfúrico concentrado, que convierte
el nitrógeno combinado en sulfato de amonio. Luego, se alcaliniza la solución,
se destila el amoniaco liberado y su cantidad se determina por medio de una
titulación con ácido de normalidad conocida. Así, por ejemplo, el amoniaco formado a partir de una muestra de
anilina de 3.51 mg, neutraliza 3.69 ml de ácido 0.0103 N. Por
![]()
Cada miliequivalente de
ácido hay un miliequivalente de amoniaco y un átomo-miligramo de nitrógeno. De
ahí puede calcularse el peso y, finalmente, el porcentaje de nitrógeno.
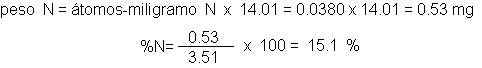
El azufre de un compuesto
orgánico se convierte en sulfato iónico por los mismos métodos empleados en en
el análisis de halógeno : un tratamiento con peróxido de sodio o con ácido
nítrico (método de Carius). Luego se transforma en sulfato de bario, que se
pesa.