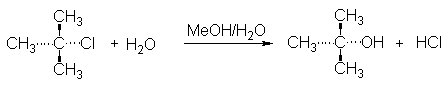
PRACTICA IV
Guión de enseñanza experimental
PAPIME
CINETICA QUIMICA
DETERMINACION DE LA CONSTANTE DE VELOCIDAD DE REACCION DE LA HIDROLISIS DEL CLORURO DE ter-BUTILO.
ENUNCIADO DEL PROBLEMA A RESOLVER POR EL ESTUDIANTE
.Que el alumno determine la relación de metanol-agua necesaria en la hidrólisis del cloruro de terbutilo para obtener una constante de velocidad de reacción que nos permita llevar a cabo la reacción con mayor eficiencia.
Reacción
Hidrólisis de cloruro de ter-butilo
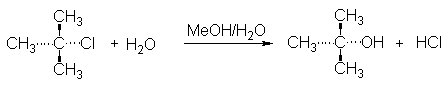
Desarrollo del experimento
Realizar el estudio cinético usando 11 pares de mezclas etanol-agua. Trabajar a temperatura constante.
Composición % en volumen etanol-agua
|
Agua |
Etanol |
|
100 |
0 |
|
90 |
10. |
|
80 |
20.5 |
|
70 |
31 |
|
60 |
41 |
|
50 |
52 |
|
40 |
62 |
|
30 |
72 |
|
20 |
81.5 |
|
10 |
90.5 |
|
0 |
100 |
Usar 1 ml de cloruro de terbutilo recien destilado y seco para cada determinación aforando a 100 ml con las diferentes mezclas de metano-agua. Tomar alícuotas de 10 ml a intervalos de 10 min titulando con NaOH 0.05N usando como indicador fenolftaleina Con los datos obtenidos calcular la K (constante de velocidad) para cada una de las mezclas.
Cálculos
Calcular K para distintos valores de t con la siguiente fórmulaK= 2.3 log a/(a-X)t
a= concentración inicial de cloruro de terbutilo en moles/ litro
= 1 ml x 0.85( densidad del t-BuCl) x 10/92(PM del t-BuCl)
=0.092 Moles/litro.
X= Vol de NaOH x Normalidad/ 10
= Moles/ litro de cloruro de terbutilo transformado en el tiempo t.
Para encontrar el valor de K por el método gráfico construya una gráfica de log(a/(a-x)) vs t. y la pendiente es el valor K ( la pendiente es igual a 2.3(m) donde m=(Y2-Y1)/(X2-X1)).
Cuestionario
1.- ¿ Por que el cloruro de terbutilo deberá ser recién destilado para realizar este estudio cinético?
2.- ¿Podría explicar por que el material que utiliza debe de estar perfectamente seco? De no ser así ¿le afectaría en sus determinaciones?
3.-¿Que observó cuando aforó con agua al 100% el mililitro de cloruro de terbutilo?
4.- ¿ Que está midiendo al hacer la valoración con NaOH?
5.- ¿Cuál es la importancia de mantener la temperatura constante durante los experimentos?
6.- ¿Cuál es la función del metanol en la reacción?
7.- Presente por escrito el conjunto de los resultados obtenidos.
8.- Estudiando sus resultados y analizando las gráficas obtenidas diga usted cual sería la mezcla metanol-agua para llevar a cabo la reacción con mayor eficiencia.
Espectros de I.R.IX. BIBLIOGRAFIA
1.-Laider K.J.
Cinética de reacciones. Vol 1
Edit. Alhambra.
Madrid, España (1971) pgs. 1-20, 19-29.
2.-Morrison R.T. y Boyd R.N.
Química Orgánica.
2ª Edición
Fondo Educativo Interamericano.
México (1985).
3.-Brewster R.Q. y Vander Werf C.A.
Curso Práctico de Química Orgánica. 2a ed.
Edit. Alhambra.
Madrid , España (1970).
pgs.82-86.
4.-Moore A.J. y Dalrymple D.L.
Experimental Methods in Organica Chemistry.2a ed.
W.B. Saunders Company.
U.S.A. (1976).
pgs. 271-275.
Diagrama de flujo de tratamiento de residuos