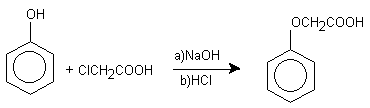
PRACTICA III
OBTENCION DE ACIDO FENOXIACETICO
I. OBJETIVOS
a) Preparar mediante una reacción de sustitución nucleofílica bimolecular un éter (Síntesis de Williamson).
b) Purificar el producto obtenido por el método de extracción selectiva.
c) Distinguir las propiedades ácidas de fenoles y ácidos carboxílicos.
REACCION :
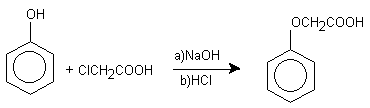
II. MATERIAL
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 1 1 |
|
1 1 |
III. SUSTANCIAS
|
0.5 g |
|
2.5 ml |
|
0.75 g |
|
7.5 ml |
|
15 ml |
|
7.5 ml |
IV. INFORMACIO
a) Los halogenuros de alquilo sufren reacciones de sustitución nucleofílica produciendo éteres.
b) Los fenoles son nucleófilos débiles pero sus sales (los fenóxidos) son nucleófilos más poderosos.
c) Los fenoles son compuestos más ácidos que el agua pero menos ácidos que el ácido carbónico.
d) Los ácidos carboxílicos orgánicos son ácidos más fuertes que el ácido carbónico.
e) Las sales iónicas de los fenoles y de los ácidos carboxílicos son solubles en agua.
V. PROCEDIMIENTO
En un matraz de pera de una boca disuelva 0.5 g de fenol (PRECAUCION !Este es muy irritante!) en 2.5 ml de NaOH al 33% (Nota 1), tape el matraz con un tapón de corcho y agite vigorosamente durante 5 min., agregue 0.75 g de ácido monocloracético, vuelva a tapar el matraz y continue la agitación por 5 minutos más. Si la mezcla se hace pastosa, puede agregar de 1 a 3 ml de agua (Nota 2). Quite el tapón y coloque el matraz sobre un baño maría con un sistema de reflujo durante 40 min. Enfríe la solución y diluya con 5 ml de agua. Acidule con HCl concentrado hasta pH de 1 (Nota 3).
Coloque la mezcla en el embudo de separación y extraiga con:
a) etér etílico usando 3 porciones de 5 ml c/u;
b) junte los extractos orgánicos y colóquelos en el embudo de separación;
c) lave la fase orgánica 3 veces con 5 ml de agua cada vez (las fracciónes acuosas se desechan) (Nota 4);
d) la fracción orgánica se extrae con Na2CO3 al 15% (3 porciones de2.5 ml c/u.);
e) el extracto acuoso alcalino (Nota 5) se acidula con HCl concentrado, (!PRECAUCION! (Nota 6)Sea cuidadoso porque se produce espuma hasta que precipita todo el producto. Se filtra y se seca al aire. Se determina rendimiento y punto de fusión.
NOTAS :
1) Comprobar la alcalinidad de la solución con papel pH.
2) Si se agrega exceso de agua, puede disolverse el producto.
3) Comprobar la acidez de la solución con papel pH.
4) Nunca deseche fracciones, hasta el final del experimento.
5) Comprobar la alcalinidad de la solución con papel pH.
6) La adición debe ser gota a gota.
VI. ANTECEDENTES
a) Reacción de sustitución nucleofílica biomolecular.
b) Diferentes métodos de obtención de éteres.
c) Síntesis de Williamson, condiciones de reacción.
d) Acidez de fenoles y de ácidos carboxílicos.
e) Propiedades físicas, químicas y toxicidad de reactivos y productos.
f) Uso de ácido fenoxiacético.
g) Extracción con disolventes activos.
VII. CUESTIONARIO
1) ¿Qué reacción ocurre entre el hidróxido de sodio y el fenol?
2) ¿Qué reacción ocurre entre el hidróxido de sodio y el ácido monocloracético?
3) ¿Qué sucede si la mezcla de reacción no contiene la suficiente cantidad de hidróxido de sodio al iniciarse la reacción?
4) Escriba un diagrama de separación que nos indique el proceso de purificación del ácido fenoxiacético.
5) Asigne las bandas principales a los grupos funcionales presentes en los espectros de I.R. de reactivos y productos.
Espectros de I.R.
a) Acido monocloroacético.
a) Brewster R.Q. Vanderwerf C.A. y Mc. Ewen W.E.
Curso Práctico de QuímicaOrgánica
3a. Edición
Ed. Alhambra S.A., Madrid (1979).
b) R.J.W. Cremlyn and R.H. Still. Named and Miscellaneous Reactions in Practical Organic Chemistry
Heinmann Educational Books Ltd.
London (1967).
c) R.T. Morrison y R.N. Boyd.
Química Orgánica
2ª Edición
Fondo Educativo Interamericano S.A.
México (1985).
d) N.L. Allinger et al.
Química Orgánica Editorial Reverté S.A., España (1975).
Diagrama de flujo de tratamiento de residuos