![]()
PRACTICA II-B
DERIVADOS HALOGENADOS
OBTENCION DE BROMURO DE N-BUTILO
I. OBJETIVOS
a) Obtener un halogenuro de alquilo primario a partir de un alcohol primario mediante una reacción de sustitución nucleofílica.
b) Investigar el mecanismo y las reacciones competitívas que ocurren durante la reacción.
REACCION :
![]()
II. MATERIAL
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
2 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
4 |
|
1 |
|
1 |
III. SUSTANCIAS
|
14.0 g |
|
20.0 g |
|
10.0 ml |
|
10.0 ml |
|
10.0 ml |
|
10.0 g |
IV. INFORMACION
La conversión de alcoholes en haluros de alquilo se puede efectuar por varios procedimientos. Con alcoholes primarios y secundarios se usan frecuentemente cloruro de tionilo o halogenuros de fósforo; también se pueden obtener calentando el alcohol con ácido clorhídrico concentrado y cloruro de zinc anhídro, o usando acido sulfúrico concentrado y bromuro de sodio. Los alcoholes terciarios se convierten al halogenuro de alquilo con ácido clorhídrico solo y en algunos casos sin calentamiento.
V. PROCEDIMIENTO
En un Matraz pera de dos bocas coloque 10 ml de agua, añada 14 g de bromuro de sodio, agite, y adicione 10 ml de n-butanol. Mezcle perfectamente, añada cuerpos de ebullición y adapte un sistema de destilación fraccionada como lo indica la figura 2.
Enfrie el matraz en un baño de hielo y pasados unos minutos adicione por la boca lateral del matraz 10 ml de ácido sulfúrico concentrado, mediante un embudo de adición, en porciones de aprox. 2 ml cada vez (Nota 1). Terminada la adición, retire el baño de hielo y el embudo de adición, y tape la boca lateral del matraz de pera con el tapón esmerilado. Adapte una trampa de solución de sosa (25 ml), según lo indica la figura 2.
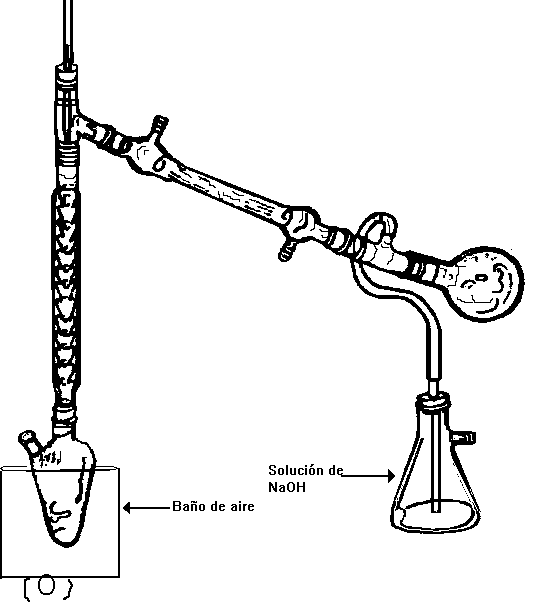
Caliente la mezcla de reacción suavemente empleando un baño de aire. Se empieza a notar el progreso de la reacción y la aparición de dos fases, siendo la fase inferior la que contiene el bromuro de n-butilo. Reciba el destilado en un recipiente enfriado en un baño de hielo (Nota 2). Continue el calentamiento hasta que el destilado es claro y no contiene gotas aceitosas.(Nota 3)
Pase el destilado al embudo de separación y lave con 5 ml de agua (el bromuro es la capa inferior), agite vigorosamente, verifique que el pH no sea ácido, en caso necesario haga otro lavado con 5 ml de agua. Transfiera el bromuro de n-butilo húmedo a un matraz Erlenmeyer y seque con sulfato de sodio anhídro. Decante al matraz de pera y destile por destilación simple, colectandose la fracción que destila entre 75-80oC en un recipiente previamente pesado .
NOTAS
1) !CUIDADO!: el ácido sulfúrico causa severas quemaduras. Use lentes de seguridad y agite después de cada adición.
2) En el condensador se forma una mezcla aceitosa de agua bromuro de n-butilo.
3) Analice cuidadosamente cada uno de los pasos involucrados en este procedimiento; trabaje con ventilación adecuada ya que puede haber desprendimientos de HBr.
VI. ANTECEDENTES
1.-Obtención de halogenuros de alquilo.
2.-Propiedades físicas, químicas y toxicidad de los reactivos y productos.
3.-Mecanismos de SN1.
4.-Mecanismos de SN2.
5.- Comparación de los mecanismos de SN1 y SN2.
6.- Estudio de las reacciones de equilibrio.
CUESTIONARIO
1.- Considerando los residuos de la mezcla de reacción. ¿Cuál procedimiento químico realizaría antes de desecharla?
2.- ¿Como eliminaría los residuos de la solución de hidróxido de sodio y de ácido sulfúrico concentrado?
3.- Asigne las bandas principales a los grupos funcionales presentes en los espectros de I.R. de reactivos y productos.
Espectros de I.R.
VII. BIBLIOGRAFIA
a) D. Pavia, G.M. Lampmann y G.S. Kriz. Jr.
Introduction to Organic Laboratory Techniques.
W.B. Saunders Co.
Philadelphia U.S.A. (1976)
pag 181-186.
b) Vogel A.I.
A textbook of Practical Organic Chemistry.
4a. Edición Longmans
Longman
London (1978).
c) R.Q. Brewster y C.A. Vander Werf.
Curso Práctico de Química Orgánica.
2a. Edición Edit. Alhambra.
España (1970).
d) K.D. Roberts y M.C. Caserio.
Modern Organic Chemistry.
W.A. Benjamin Inc.
U.S.A. (1967)
e) N.L. Allinger et all.
Química Orgánica.
Editorial Reverté S.A.
España (1975).
f) R.T. Morrison y R.N. Boyd.
Química Orgánica
2ª Edición
Fondo Educativo Interamericano.
México (1985).